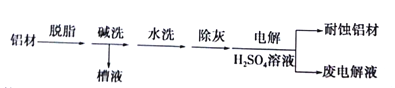
题目内容
【题目】Fe(OH)3广泛应用于医药制剂、颜料制造等领域,其制备步骤及装置如下:在三颈烧瓶中加入16.7gFeSO4·7H2O和40.0ml蒸馏水。边搅拌边缓慢加入3.0mL浓H2SO4,再加入2.0gNaClO3固体。水浴加热至80℃,搅拌一段时间后,加入NaOH溶液,充分反应。经过滤、洗涤、干燥得产品。
(1)NaClO3氧化FeSO4·7H2O的离子方程式为_____________。
(2)加入浓硫酸的作用为_________(填标号)。
a.提供酸性环境,增强NaClO3氧化性 b.脱去FeSO4·7H2O的结晶水
c.抑制Fe3+水解 d.作为氧化剂
(3)检验Fe2+已经完全被氧化需使用的试剂是_________。
(4)研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,设计对比实验如下表
编号 | T/℃ | FeSO4·7H2O/g | NaClO3/g | 氧化效果/% |
i | 70 | 25 | 1.6 | a |
ii | 70 | 25 | m | b |
iii | 80 | n | 2.0 | c |
iv | 80 | 25 | 1.6 | 87.8 |
①m=______;n=______。
②若c>87.8>a,则a、b、c的大小关系为___________。
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,其原因是___
(6)判断Fe(OH)3沉淀洗涤干净的实验操作为_________________;
(7)设计实验证明制得的产品含FeOOH(假设不含其他杂质)。___________。
【答案】ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O a、c K3[Fe(CN)6]溶液 2.0 25 c>b>a 若温度过低,Fe(OH)3胶体未充分聚沉收集,导致产率下降 取最后一次洗涤液于两只试管中,分别滴加HCl酸化的BaCl2溶液和HNO3酸化的AgNO3溶液,若都无白色沉淀,则说明Fe(OH)3沉淀洗涤干净 称取mg样品,加热至恒重后称重,剩余固体质量大于![]()
【解析】
(1)NaClO3具有氧化性,在酸性条件下将FeSO4·7H2O氧化为硫酸铁,据此书写;
(2) NaClO3具有氧化性,在酸性条件下氧化性增强;同时反应产生的Fe3+会发生水解反应,根据盐的水解规律分析分析;
(3)检验Fe2+已经完全被氧化,就要证明溶液在无Fe2+;
(4)实验是研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,根据表格数据可知i、ii是研究NaClO3用量的影响;ii、iii或i、iv是研究温度的影响;据此分析解答;
(5)温度低,盐水解程度小,不能充分聚沉;
(6) Fe(OH)3沉淀是从含有NaCl、H2SO4的溶液在析出的,只要检验无Cl-或SO42-就可证明洗涤干净;
(7)根据Fe元素守恒,若含有FeOOH,最后得到的固体质量比Fe(OH)3多。
(1)NaClO3具有氧化性,在酸性条件下将FeSO4·7H2O氧化为硫酸铁,NaClO3被还原为NaCl,同时产生水,反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(2) NaClO3氧化FeSO4·7H2O时,为了增强其氧化性,要加入酸,因此提供酸性环境,增强NaClO3氧化性,选项a合理;同时FeSO4·7H2O被氧化为Fe2(SO4)3,该盐是强酸弱碱盐,在溶液中Fe3+发生水解反应使溶液显酸性,为抑制Fe3+的水解,同时又不引入杂质离子,因此要向溶液中加入硫酸,选项c合理,故答案为ac;
(3)检验Fe2+已经完全被氧化,只要证明溶液中无Fe2+即可,检验方法是取反应后的溶液少许,向其中滴加K3[Fe(CN)6]溶液,若溶液无蓝色沉淀产生,就证明Fe2+已经完全被氧化为Fe3+;
(4)①根据实验目的,i、ii是在相同温度下,研究NaClO3用量的影响,ii、iii或i、iv是研究温度的影响;因此m=2,n=25;
②在其它条件不变时,增大反应物的浓度,化学反应速率加快,实验b>a;ii、iii的反应物浓度相同时,升高温度,化学反应速率大大加快,实验c>b,因此三者关系为c>b>a;
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,原因是温度过低,Fe(OH)3胶体未充分聚沉收集,导致产率下降;
(6) Fe(OH)3沉淀是从含有NaCl、H2SO4的溶液在析出的,若最后的洗涤液中无Cl-或SO42-就可证明洗涤干净。方法是取最后一次洗涤液于两只试管中,分别滴加HCl酸化的BaCl2溶液和HNO3酸化的AgNO3溶液,若都无白色沉淀,则说明Fe(OH)3沉淀洗涤干净;
(7)在最后得到的沉淀Fe(OH)3中若含有FeOOH,由于Fe(OH)3中比FeOOH中Fe元素的含量多。由于1molFe(OH)3质量是107g,完全灼烧后产生0.5molFe2O3,质量是80g,若称取mg Fe(OH)3,完全灼烧后固体质量是![]() ,若样品中含有FeOOH,加热至恒重后称重,剩余固体质量大于
,若样品中含有FeOOH,加热至恒重后称重,剩余固体质量大于![]() 。
。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案