��Ŀ����
2����֪��
����ȲΪԭ�ϣ�ͨ����ͼ��ʾ�����ܺϳ��л��м���E��ת�������з�Ӧ���������ֲ�������ȥ����

���У�A��B��C��D�ֱ����һ���л��B�Ļ�ѧʽΪC4H10O2������������
��ش��������⣺
��1��д������A�Ļ�ѧ��Ӧ����ʽ��HC��CH+2HCHO $\stackrel{һ��������}{��}$HOCH2C��CCH2OH��
��2��B��Ũ������¼��ȣ������ɶ����л����д��1����Է���������AС���л�����Ľṹ��ʽ��CH2=CHCH2CH2OH��CH2=CHCH=CH2��
��3��д��C����D�Ļ�ѧ��Ӧ����ʽ��2OHCCH2CH2CHO$\stackrel{һ��������}{��}$
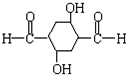 ��
����4�����б���������E��Ϊͬ���칹�������6�֣�д������һ��ͬ���칹��Ľṹ��ʽ��
 ��������һ�֣���
��������һ�֣���
���� ��Ȳ��HCHO������Ϣ�еļӳɷ�ӦA��A�����������ӳɷ�Ӧ����B��B�ķ���ʽC4H10O2����Ȳ���ȩ�ķ�Ӧ��1������Ȳ��2���Ӽ�ȩ�����ӳɷ�Ӧ����AΪHOCH2C��CCH2OH��HOCH2C��CCH2OH�����������ӳɷ�Ӧ����B����BΪHOCH2CH2CH2CH2OH��B��������������C��CΪOHCCH2CH2CHO��C������������Ϣ��ȩ�ļӳɷ�Ӧ����D����DΪ ��D��Ũ���ᡢ���������·�����ȥ��Ӧ����E���ݴ˷������
��D��Ũ���ᡢ���������·�����ȥ��Ӧ����E���ݴ˷������
��� �⣺��Ȳ��HCHO������Ϣ�еļӳɷ�ӦA��A�����������ӳɷ�Ӧ����B��B�ķ���ʽC4H10O2����Ȳ���ȩ�ķ�Ӧ��1������Ȳ��2���Ӽ�ȩ�����ӳɷ�Ӧ����AΪHOCH2C��CCH2OH��HOCH2C��CCH2OH�����������ӳɷ�Ӧ����B����BΪHOCH2CH2CH2CH2OH��B��������������C��CΪOHCCH2CH2CHO��C������������Ϣ��ȩ�ļӳɷ�Ӧ����D����DΪ ��D��Ũ���ᡢ���������·�����ȥ��Ӧ����E��
��D��Ũ���ᡢ���������·�����ȥ��Ӧ����E��
��1����Ȳ�ͼ�ȩ��Ӧ����A����Ӧ����ʽΪHC��CH+2HCHO $\stackrel{һ��������}{��}$HOCH2C��CCH2OH��
�ʴ�Ϊ��HC��CH+2HCHO $\stackrel{һ��������}{��}$HOCH2C��CCH2OH��
��2��BΪHOCH2CH2CH2CH2OH��B��Ũ������¼��ȣ������ɶ����л����������Է���������AС���л�����Ľṹ��ʽΪCH2=CHCH2CH2OH��CH2=CHCH=CH2�ȣ�
�ʴ�Ϊ��CH2=CHCH2CH2OH��CH2=CHCH=CH2��
��3��CΪOHCCH2CH2CHO��C������������Ϣ��ȩ�ļӳɷ�Ӧ����D����Ӧ�Ļ�ѧ��Ӧ����ʽΪ2OHCCH2CH2CHO $\stackrel{һ��������}{��}$ ��
��
�ʴ�Ϊ��2OHCCH2CH2CHO $\stackrel{һ��������}{��}$ ��
��
��4�����б���������E��Ϊͬ���칹������нṹ��ʽΪ ��������6�֣�
��������6�֣�
�ʴ�Ϊ��6�� ��������һ�֣���
��������һ�֣���
���� ���⿼���л����ƶϣ����ؿ���ѧ����ȡ��Ϣ������Ϣ���������������Ϣ��Ϸ�Ӧ���������ƶϣ���ȷ�ƶϸ����ʽṹ��ʽ�ǽⱾ��ؼ����ѵ��ǣ�4��ͬ���칹�������жϣ���Ŀ�Ѷ��еȣ�

| A�� | CO2ͨ������ʯ��ˮ�з�Ӧ�IJ���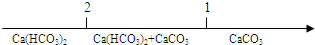 $\frac{n��C{O}_{2}��}{n[Ca��OH��_{2}]}$ $\frac{n��C{O}_{2}��}{n[Ca��OH��_{2}]}$ | |
| B�� | Fe��Cl2�е�ȼ�ղ�� $\frac{n��C{l}_{2}��}{n��Fe��}$ $\frac{n��C{l}_{2}��}{n��Fe��}$ | |
| C�� | AlCl3��Һ�еμ�NaOH�����Ĵ�����ʽ�� $\frac{n��NaOH��}{n��AlC{l}_{3}��}$ $\frac{n��NaOH��}{n��AlC{l}_{3}��}$ | |
| D�� | ��ˮ��SO2��Ӧ����Һ�е���Σ�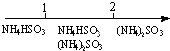 $\frac{n��N{H}_{3}{H}_{2}O��}{n��S{O}_{2}��}$11 $\frac{n��N{H}_{3}{H}_{2}O��}{n��S{O}_{2}��}$11 |
| A�� | �����������������Ȼ�泥�����Ũ��ˮ�������������Ĺܵ��Ƿ�й© | |
| B�� | SO2��ǿ��ԭ�ԣ���SO2Ư��ֽ�� | |
| C�� | ��ʯ����ˮ�ĺ�״������ܿ����̣�����������ģ�ͺ�ʯ����� | |
| D�� | ����ǿ��ԭ����ת��Ϊ������ʱ�ų��������ȣ�������������ԭijЩ���������� |
��Ca��OH��2��Al2O3��Ca��HCO3��2��Al��OH����NaHSO4��Al�ߣ�NH4��2S��
| A�� | �ڢܢ� | B�� | �ڢۢݢ� | C�� | �٢ۢܢ� | D�� | �ڢۢܢޢ� |
| A�� | ��ȼ�ľƾ��Ʋ�С�ش����ˣ�����������ˮ��� | |
| B�� | Ƥ��մ��Ũ��������ˮϴ������ϡ����ͿĨ | |
| C�� | �Ʊ�����ˮ�У�Ϊ��ֹ���пɽ����Һ����һ��ʱ����ټӷ����Ƭ | |
| D�� | ������������������ʱ��Ϊ��ֹ�л��������ݳ�����ʹ��������ĩ�˳��� |
| A�� | V��40 | B�� | 20��V��40 | C�� | V=40 | D�� | V=20 |
| A�� | ��ȩ�Ľṹʽ��HCHO | B�� | ������ӵı���ģ�ͣ� | ||
| C�� | ���Ȼ�̼���ӵĵ���ʽ��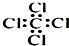 | D�� | 2-�һ�-1��3-����ϩ���ӵļ���ʽ��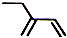 |