题目内容
【题目】钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是(填序号).
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:
(3)碳酸氢钠是一种(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3﹣、H2CO3、CO32﹣、OH﹣五种微粒浓度由大到小的顺序为: .
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:
②几种离子开始沉淀时的pH下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 . ( Ksp[Cu(OH)2]=2×10﹣20 )
【答案】
(1)C
(2)<;②>①
(3)强;c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H2CO3)>c(CO32﹣)
(4)c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+);Cu2+;<;6
【解析】解:(1)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32﹣;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故选C,
所以答案是:CO32﹣;C;
(2.)碳酸钠和碳酸氢钠促进水的电离,碳酸根离子水解程度大,则碳酸钠中水的电离程度大,即溶液中水电离出的H+个数:②>①,Na2CO3溶液中CO32﹣的水解大于乙中HCO3﹣的水解,则碳酸钠中阴离子浓度之和大,即溶液中阴离子的物质的量浓度之和:②>①,
所以答案是:<;:②>①;
(3.)碳酸氢钠属于盐类,在水溶液里完全电离生成钠离子和碳酸氢根离子,属于强电解质,HCO3﹣水解生成碳酸分子与氢氧根离子,水解离子方程式为:HCO3﹣+H2OH2CO3+OH﹣ , 常温下,0.1molL﹣1NaHCO3溶液的pH大于8,c(OH﹣)>c(H+),说明HCO3﹣水解程度大于其电离程度,故c(Na+)>c(HCO3﹣)、c(H2CO3)>c(CO32﹣),水解程度不大所以c(HCO3﹣)>c(H2CO3)、c(HCO3﹣)>c(OH﹣),溶液中氢氧根来源于水的电离与HCO3﹣水解,故c(OH﹣)>c(H2CO3),所以c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H2CO3)>c(CO32﹣),
所以答案是:强;HCO3﹣+H2OH2CO3+OH﹣;c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H2CO3)>c(CO32﹣);
(4.)①300mL 1molL﹣1的NaOH的物质的量=1mol/L×0.3L=0.3mol,标准状况下4.48LCO2的物质的量= ![]() =0.2mol,所以氢氧化钠和二氧化碳反应方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即c(OH﹣)>c(H+),碳酸根离子水解生成碳酸氢根离子,所以c(HCO3﹣)>c(CO32﹣),由于水解程度较小,所以c(CO32﹣)>c(OH﹣),故溶液中各离子浓度大小顺序是c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),
=0.2mol,所以氢氧化钠和二氧化碳反应方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即c(OH﹣)>c(H+),碳酸根离子水解生成碳酸氢根离子,所以c(HCO3﹣)>c(CO32﹣),由于水解程度较小,所以c(CO32﹣)>c(OH﹣),故溶液中各离子浓度大小顺序是c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),
所以答案是:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+);
②pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2],0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H﹣)= ![]() =10﹣8mol/L,c(H+)=10﹣6mol/L,所以pH=6,
=10﹣8mol/L,c(H+)=10﹣6mol/L,所以pH=6,
所以答案是:Cu2+;<;6.

【题目】Si3N4是一种重要的新型无机非金属材料,能被强碱腐蚀;实验室可利用SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅,实验装置示意图(加热和夹持装置略去)和有关性质如下: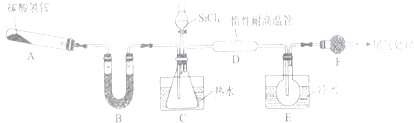
物质 | 熔点/℃ | 沸点/℃ | |
SiCl4 | ﹣70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
Si3N4 | 1900 | ﹣ | 性质稳定 |
请回答下列问题:
(1)装置B中所加入的试剂名称为 .
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为 .
(3)反应开始前先组装好仪器,(填操作步骤)后,再加装药品,接下来的操作是(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为 .
(5)反应过程中,装置E中的现象为 .
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000molL﹣1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500molL﹣1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为 .
②产品中Si3N4的质量分数为(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为 .




