题目内容
【题目】某条件下,在2 L密闭容器中发生如下反应:2NO2 (g)![]() 2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
2NO (g)+O2 (g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度 (mol·L-1)随时间 (min)的变化如图所示。请回答下列问题:
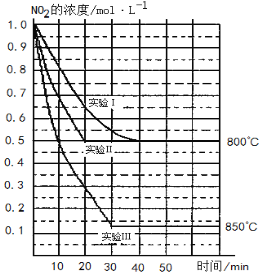
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡时NO2浓度减少了0.5mol/L,则根据方程式可知生成氧气是0.25mol/L,因此用氧气浓度变化表示的化学反应速率为0.25mol/L÷20min= 。
(3)800℃时,该反应的平衡常数K= 。该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体 (保持温度不变),此时平衡将向 移动 (填“正反应方向”或“逆反应方向”),你判断的依据是 。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,如:8NH3+6NO2![]() 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
【答案】 (1)使用了催化剂
(2)0.0125mol·L-1·min-1
(3)0.25 ;吸
(4)向正反应方向 Qc=0.75×0.252/12<0.25×0.52/0.52=K
(5)2NO2+4CO2+8e- =N2+4CO32-
【解析】
试题分析: (1)因实验Ⅰ和实验Ⅱ平衡时NO2的浓度相同,但实验Ⅱ反应速率大,则实验Ⅱ使用了催化剂;
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为0.0125mol·L-1·min-1。
(3)根据图像可知实验Ⅱ中平衡时NO2、NO和氧气的浓度分别是0.5mol/L、0.5mol/L、0.25mol/L,则该温度下平衡常数K=c (NO)2×c (O2)/c (NO2)2=![]() ;根据图像可知温度越高,平衡时NO2的浓度越小,则正反应为吸热反应;
;根据图像可知温度越高,平衡时NO2的浓度越小,则正反应为吸热反应;
(4)由于此时Qc=0.75×0.252/12<0.25,所以反应向正反应方向进行。
(5)原电池中正极得到电子,发生还原反应。根据反应式可知正极是NO2得到电子,则正极反应方程式为2NO2+4CO2+8e-=N2+4CO32-。