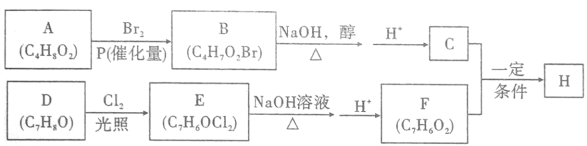
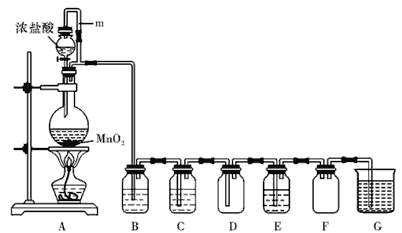
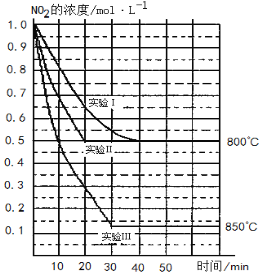
题目内容
【题目】钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2=2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为Fe-2e-=Fe2+
B.正极发生的反应为2H2O+O2+2e-=4OH-
C.原电池是将电能转化为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
【答案】A
【解析】由原电池反应式知:负极为Fe-2e-=Fe2+,正极为2H2O+O2+4e-=4OH-,A项正确、B项错误;原电池是将化学能转化为电能的装置,C项错误;根据原电池原理,钢柱在空气与水交界处更容易腐蚀,D项错误。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO (OH)2,因此配制KMnO4标准溶液的操作是: (1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h; (2)用微孔玻璃漏斗过滤除去难溶的MnO (OH)2; (3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处; (4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂 (纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用 (填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用 (填序号)。
A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是 ;
②所配制KMnO4标准溶液的物质的量浓度为 ;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 (填“偏高”或“偏低”)。
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去CO中少量的CO2 | 通过足量灼热CuO |
B | 除去CuCO3溶液中的少量 CuO | 加入足量稀H2SO4后,过滤 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
D | 鉴别硬水和软水 | 加入肥皂水 |