��Ŀ����
����Ŀ����Ҫ��ش��������⣺ I���������ʵ�����A��B��Ϸ���2L���ܱ������У�������Ӧ3A��g��+B��g��xC��g��+2D��g������5min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��c��A����c��B��=3��5��v��C��=0.1mol/��Lmin������
��1��x= ��
��2��ǰ5min��B�ķ�Ӧ����v��B��= ��
��3��ƽ��ʱA��ת����Ϊ ��
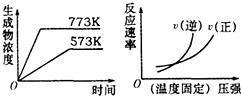
��4��II��ˮ����ͨ�����ȵ�̼�㷢����Ӧ��C��s��+H2O��g��CO��g��+H2��g����H�� ��֪��K��300�棩��K��350�棩����÷�Ӧ���ȷ�Ӧ��
��5��������Ӧ��t0ʱ�̴ﵽƽ�⣬��t1ʱ�̸ı�ijһ����������Ӧ���ʣ���������ʱ��ı仯����ͼ��ʾ�������Ӧ�ı�ţ� 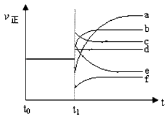
����С��������� �ڽ����¶�
��6����֪��Ӧ��CO��g��+CuO��g��CO2��g��+Cu��s����H2��g��+CuO��g��Cu��s��+H2O��g�� ����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2 �� ���¶��·�ӦCO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��K=����K1��K2��ʾ����
���𰸡�
��1��2
��2��0.05mol/��L?min��
��3��50%
��4����
��5��b�� f
��6��![]()
���������⣺I��D��Ũ��Ϊ0.5mol/L������D�����ʵ���Ϊ1mol��C���ʵ���=0.1mol/��Lmin����2L��5min=1mol��
��A��B�����ʵ���Ϊnmol��
3A��g��+ | B��g��= | xC��g��+ | 2D��g�� | |
��ʼ(mol) | n | n | 0 | 0 |
ת��(mol) | 1.5 | 0.5 | 1 | 1 |
5min(mol) | n-1.5 | n-0.5 | 1 | 1 |
ͬһ�����У�c��A����c��B��=n��A����n��B��= ![]() =
= ![]() ��n=3mol����1��C�ķ�Ӧ������0.1mol/��Lmin����C���ʵ���=0.1mol/��Lmin����2L��5min=1mol��
��n=3mol����1��C�ķ�Ӧ������0.1mol/��Lmin����C���ʵ���=0.1mol/��Lmin����2L��5min=1mol�� ![]() =1������x=2��
=1������x=2��
���Դ��ǣ�2����2��C�ķ�Ӧ������0.1mol/��Lmin��������ͬһ��Ӧ�У������ʵķ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����B�ķ�Ӧ������ ![]() ��0.1mol/��Lmin��=0.05mol/��Lmin����
��0.1mol/��Lmin��=0.05mol/��Lmin����
���Դ��ǣ�0.05mol/��Lmin������3��A��ת����Ϊ�� ![]() ��100%=50%�����Դ��ǣ�50%��
��100%=50%�����Դ��ǣ�50%��
��4����֪��K��300�棩��K��350�棩�����¶�����ƽ�ⳣ������˵��ƽ��������У�����ӦΪ���ȷ�Ӧ�����Դ��ǣ����� ��5������С���������ѹǿ����˲�����淴Ӧ���ʶ�����ƽ�����淴Ӧ�����ƶ����淴Ӧ����������࣬�������Ӧ����������ƽ�⣬������b���ϣ�
���Դ��ǣ�b��
�ڽ����¶ȣ�˲�����淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�������Ӧ���ʼ�С���࣬�������Ӧ����������ƽ�⣬������ƽ��ʱ������С��ԭƽ������ʣ�����f���ϣ����Դ��ǣ�f����6����CO��g��+CuO��g��CO2��g��+Cu��s����H2��g��+CuO��g��Cu��s��+H2O��g����
��Ӧ�ٵ�ƽ�ⳣ��K1= ![]() ����Ӧ�ڵ�ƽ�ⳣ��K2=
����Ӧ�ڵ�ƽ�ⳣ��K2= ![]() ����Ӧ�ۣ�CO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��ΪK=
����Ӧ�ۣ�CO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��ΪK= ![]() =
= ![]() ��
��
���Դ��ǣ� ![]() ��
��

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�����Ŀ��ijС������H2C2O4��Һ�������ữ��KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱͨ���ⶨ����KMnO4��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�������֪��KMnO4��H2C2O4��H2SO4��K2SO4��MnSO4��CO2����H2O ��δ��ƽ����
0.1mol��L��1KMnO4������Һ�����/mL | 0. 6mol��L��1 H2C2O4��Һ�����/mL | H2O�Ļ�/mL | ʵ���¶�/�� | ��Һ��ɫʱ����ʱ��/min | |
ʵ��1 | 10 | V1 | 35 | 25 | |
ʵ��2 | 10 | 10 | 30 | 25 | |
ʵ��3 | 10 | 10 | V2 | 50 |
(1)����V1=___________mL , V2=___________mL��
(2)̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������____________��
(3)ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ2 min�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��________________��
(4)��֪50 ��ʱc(MnO![]() )����Ӧʱ��t�ı仯������ͼ�������������������䣬��������ͼ�У�����25 ��ʱc(MnO
)����Ӧʱ��t�ı仯������ͼ�������������������䣬��������ͼ�У�����25 ��ʱc(MnO![]() )��t�ı仯����ʾ��ͼ________��
)��t�ı仯����ʾ��ͼ________��