题目内容
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、________________。
(2)用碱式滴定管量取10.00mL待测液,置于锥形瓶中,同时滴加1-2滴指示剂。化学上常选用的指示剂有酚酞或____________。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视__________________,直到滴定到终点,若选择酚酞作为指示剂,判断滴定终点的标志是___________________________。
(4)根据下列数据,测得c(NaOH)=________。烧碱的纯度=____________。
滴定 次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.00 | 24.10 |
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液,下列操作引起待测液浓度偏小的是 _______________(填序号)。
①读数:滴定前平视,滴定后俯视②未用待测液润洗碱式滴定管
③用待测液润洗锥形瓶④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
【答案】 100mL容量瓶 胶头滴管 甲基橙 锥形瓶中溶液颜色的变化 当滴入最后一滴时,溶液颜色恰好由红色变为无色,且半分钟内不复原,则达到滴定终点 0.4020mol·L-1 80.4% ①②
【解析】(1).将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有100mL容量瓶和胶头滴管,故答案为:100mL容量瓶;胶头滴管;
(2).因石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂,因此化学上常选用的指示剂有酚酞或甲基橙,故答案为:甲基橙;
(3).在酸碱中和滴定实验中,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定达到终点;若选择酚酞作为指示剂,判断滴定终点的标志是: 当滴入最后一滴时,溶液颜色恰好由红色变为无色,且半分钟内不复原,则达到滴定终点,故答案为:锥形瓶中溶液颜色的变化;当滴入最后一滴时,溶液颜色恰好由红色变为无色,且半分钟内不复原,则达到滴定终点;
(4).三次滴定分别消耗盐酸标准液的体积为:19.90mL、20.10mL、23.10mL,因第三次滴定的数据偏差较大,舍去,则消耗盐酸标准液的平均体积为: ![]() =20.00mL,则c(NaOH)=
=20.00mL,则c(NaOH)=![]() =0.4020mol·L-1,n(NaOH)=0.4020mol·L-1×0.100L=4.020mol,则烧碱的纯度=
=0.4020mol·L-1,n(NaOH)=0.4020mol·L-1×0.100L=4.020mol,则烧碱的纯度=![]() =80.4%,故答案为:0.4020mol·L-1;80.4%;
=80.4%,故答案为:0.4020mol·L-1;80.4%;
(5). ①读数:滴定前平视,滴定后俯视,会使标准液的体积偏小,测定的待测液浓度偏小,故①符合;②未用待测液润洗碱式滴定管,会使待测液被稀释,造成标准液的体积偏小,测定的待测液浓度偏小,故②符合;③用待测液润洗锥形瓶,会使消耗的标准液偏多,测定的待测液浓度偏大,③不符合;④不小心将标准液滴在锥形瓶外面,会使消耗的标准液偏多,测定的待测液浓度偏大,④不符合;⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,对测定结果无影响,⑤不符合;故答案为:①②。

 阅读快车系列答案
阅读快车系列答案【题目】有一类组成最简单的有机硅化合物,它的分子组成与烷烃相似,下列说法错误的是( )
A.甲硅烷的分子式为SiH4
B.甲硅烷燃烧生成SiO2和H2O
C.甲硅烷的密度比甲烷小
D.甲硅烷的热稳定性比甲烷弱
【题目】下列物质的用途与其体现的性质对应关系不合理的是( )
物质 | 用途 | 体现的性质 | |
A | SO2 | 生产硫酸 | 还原性 |
B | NH3 | 生产碳酸氢铵 | 还原性 |
C | SiO2 | 制取硅单质 | 氧化性 |
D | Fe2O3 | 冶炼金属铁 | 氧化性 |
A.AB.BC.CD.D
【题目】电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质. 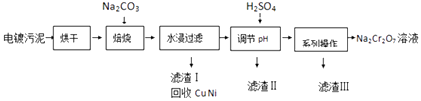
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
20℃ | 60℃ | 100℃ | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
(1)焙烧过程中生成Na2CrO4的化学方程式为;水浸后溶液中除Na2CrO4还存在的溶质有和;
(2)加入H2SO4调节pH的目的为;
(3)得到滤渣Ⅲ的“系列操作”的步骤为、过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42﹣有8/9转化为Cr2O72﹣ , 求转化后所得溶液中c(Cr2O72﹣)=molL﹣1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2 , 再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5 , 则发生反应的化学方程式为 .