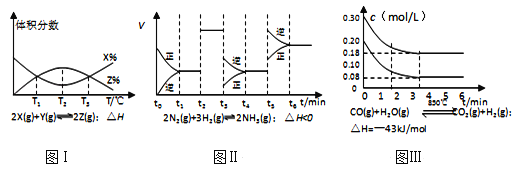
题目内容
【题目】孔雀石是含铜的碳酸盐矿物,主要成分为 Cu2(OH)2CO3,工业上以孔雀石(主要杂质有FeCO3、FeO、SiO2)制备胆矾的一般流程如下:
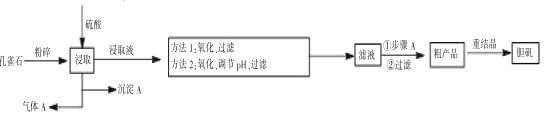
注:重结晶目的是为了除尽Fe3+
回答下列问题:
(1)写出气体A 的电子式______________。
(2)方法 1 的原理是用微酸性的高锰酸钾溶液将二价铁氧化为 Fe(OH)3,使之与 MnO2 共沉淀,易于过滤,除铁效果好,稍有过量,溶液即显微红色,便于掌握。稍过量的高锰酸钾会自动分解,产生 MnO2 和一种无毒的气体,请完善此反应的离子反应方程式:_____MnO4- +________H+ = __MnO2↓ + ____+ _____
(3)方法 1 的不足之处是在酸性条件下会发生副反应__________________ (写出离子方程式),产物Mn2+进入溶液,需要后续步骤除去,同时 Fe3+水解也不易彻底。因而实际生产中更多采用的是方法 2,用过氧化氢作为氧化剂,优点是____。氧化后调节pH 沉淀出氢氧化铁,但需注意pH 不可过高,否则造成的影响是_____。
(4)若在实验室进行步骤A 操作,需要用到的硅酸盐仪器有 _________________ 。
(5)CuSO4·5H2O 含量的测定:称取 0.5g 样品,溶于水,移入 100mL 容量瓶中,稀释至刻度,量取 25.00mL,稀释至 100mL,加入10mL 氨-氯化铵缓冲溶液(pH=10)及 0.2g 红紫酸铵混合指示剂,摇匀,用浓度为 cmol·L-1 EDTA 标准溶液滴定至溶液呈紫蓝色不变,重复三次,平均消耗的标准溶液体积为VmL。 (EDTA 能与大多数金属离子形成稳定的 1:1 络合物,是络合滴定中的常用滴定试剂)
①计算CuSO4·5H2O 质量分数 ______________。
②若不进行重结晶操作,计算出的质量分数结果会__________。(填偏低、偏高或者无影响)。
【答案】![]() 4 4 4 3O2↑ 2H2O MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 还原产物为水,不引入其他杂质离子 Cu2+水解程度增大,产率降低 酒精灯、蒸发皿、玻璃棒 2cV×100% 偏高
4 4 4 3O2↑ 2H2O MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 还原产物为水,不引入其他杂质离子 Cu2+水解程度增大,产率降低 酒精灯、蒸发皿、玻璃棒 2cV×100% 偏高
【解析】
孔雀石主要成分为 Cu2(OH)2CO3,主要杂质有FeCO3、FeO、SiO2,粉碎后加入硫酸除SiO2均可溶于硫酸,所以得到的沉淀A为SiO2;孔雀石的主要成分和某些杂质中都含有碳酸根,则在和硫酸反应时会生成二氧化碳气体,所以气体A为CO2;得到的浸取液中主要金属阳离子有Fe2+、Fe3+、Cu2+;之后通过方法一或方法二进行除杂,两种方法共同点都是先将亚铁离子氧化成铁离子再进行除杂;之后进行过滤得到硫酸铜溶液,经蒸发浓缩、冷却结晶、过滤得到粗产品,再通过重结晶进行进一步除杂。
(1)根据分析可知气体A为CO2,其电子式为![]() ;
;
(2)根据题目信息可知过量的高锰酸钾自行分解过程中还原产物为MnO2,根据元素的价态变化规律,K元素和H元素化合物价已为最高价不能再升高,则只能是氧元素化合价生高,即氧化产物为O2,根据电子守恒和元素守恒可得方程式为:4MnO4- +4H+ =4MnO2↓ +3O2↑+2H2O;
(3)根据题目信息可知酸性条件下高锰酸钾氧化亚铁离子时还原产物可能为Mn2+,根据电子守恒和元素守恒可知方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;过氧化氢做氧化剂,其还原产物为水,既不污染环境也不引入新的杂质;pH过高,促进铜离子水解,产生氢氧化铜沉淀,产率降低;
(4)步骤A为蒸发浓缩、冷却结晶,用到的硅酸盐仪器有酒精灯、蒸发皿、玻璃棒;
(5)①根据题目信息“EDTA 能与大多数金属离子形成稳定的 1:1 络合物”可知滴定过程中n(Cu2+)=n(EDTA),则待测液中n(Cu2+)=V×10-3L×cmol·L-1 =cV×10-3mol,所以样品中所含n(CuSO4·5H2O)= Vc×10-3mol×![]() =4cV×10-3mol,所以CuSO4·5H2O 质量分数为
=4cV×10-3mol,所以CuSO4·5H2O 质量分数为![]() = 2cV×100%;
= 2cV×100%;
②若不进行重结晶,则会有Fe3+,导致单位质量的样品消耗更多的EDTA标准液,测得的CuSO4·5H2O 质量分数偏高。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案【题目】苯甲酸乙酯(C9H10O2)的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为: ![]() +CH3CH2OH
+CH3CH2OH![]()
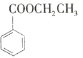 +H2O
+H2O
已知:苯甲酸在100℃会迅速升华。相关有机物的性质如表所示。
名称 | 相对分子质量 | 颜色、状态 | 沸点/℃ | 密度/(g﹒cm-3) |
苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底瓶中加入12.20g苯甲酸,25mL95%的乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。

②反应结束,打开旋塞放出分水器中的液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是________(填序号)。
A. 25mL B.50mL C. 100mL D. 250mL
(2)步骤①中使用分水器不断分离除去水的目的是___________。
(3)步骤②中应控制蒸馏的温度为_______(填序号)。
A. 65~70℃ B. 78~80℃ C. 80~85℃ D. 215~220℃
(4)步骤③加入Na2CO3的作用是_______;若Na2CO3的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________。
(5)关于步骤③中的萃取分液操作的叙述正确的是__________(填序号)。
A. 水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B. 振摇几次后需打开分液漏斗上口的玻璃塞放气
C. 经几次振摇并放气后,手持分液漏斗静置待液体分层
D. 放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算可得本实验的产率为__________。