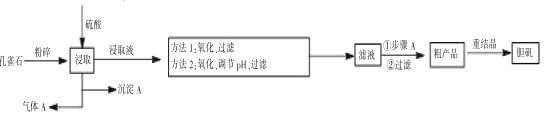
题目内容
【题目】常温下用0.1mol/L NaOH溶液滴定40mL 0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是

A.Ka2(H2SO3)的数量级为10-8
B.若滴定到第一反应终点,可用甲基橙作指示剂
C.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
【答案】D
【解析】
A.据图可知c(SO32-)=c(HSO3-)时pH=7.19,Ka2(H2SO3)= c(H+)=10-7.19,则Ka2(H2SO3)的数量级为10-8,故A正确;
c(H+)=10-7.19,则Ka2(H2SO3)的数量级为10-8,故A正确;
B.甲基橙的变色范围为3.1-4.4,滴定第一反应终点pH在4.25,所以可以选取甲基橙作指示剂,溶液由红色变为橙色,故B正确;
C.Y点溶液中存在电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),且该点c(SO32-)=c(HSO3-),所以存在3c(SO32-)=c(Na+)+c(H+)-c(OH-),故C正确;
D.Z点溶质为Na2SO3,SO32-水解生成HSO3-,SO32-水解和水电离都生成OH-,所以c(HSO3-)<c(OH-),故D错误;
故答案为D。

练习册系列答案
相关题目
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag