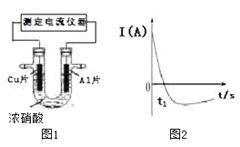
题目内容
【题目】在 20 ℃时,某气态烃与氧气混合,装入密闭容器中,点燃爆炸后,又恢复到 20 ℃, 此时容器内气体的压强为反应前的一半,经 NaOH 溶液吸收后,容器内几乎成真空,此 烃的分子式可能是( )
A.CH4B.C2H6C.C3H6D.C3H8
【答案】D
【解析】
在密闭环境下,同温同体积,根据阿伏伽德罗定律PV=nRT(R为常数)进行计算,有机物燃烧产生水和二氧化碳,20 ℃时水为液体,氢氧化钠与二氧化碳反应,容器真空即恰好反应完全,无氧气剩余。
根据阿伏伽德罗定律PV=nRT(R为常数),反应结束后,容器内气体的压强为反应前的一半,在同温同体积时,压强之比等于物质的量之比,即n(CO2)=0.5n某烃+氧气;根据有机物燃烧通式,设有机物分子式为CxHy,则1molCxHy消耗(x+0.25y)mol氧气,产生xmol二氧化碳,即1+x+0.25y =2x,x=1+0.25y。综上所述,满足题意的有机物结构为C3H8。
答案为D。
![]()

【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯。
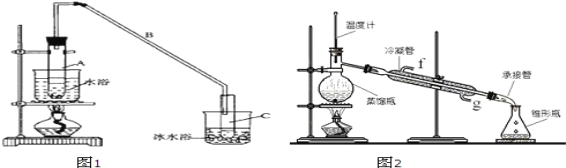
已知: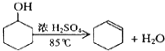
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
环乙烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____。
②试管C置于冰水浴中的目的是_____。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层。(填上或下)
②再将环己烯按图2装置蒸馏,冷却水从口进入_____(填“g”或“f”)。收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,最可能的原因是_____。
A.蒸馏时从70℃开始收集产品
B.环已醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出