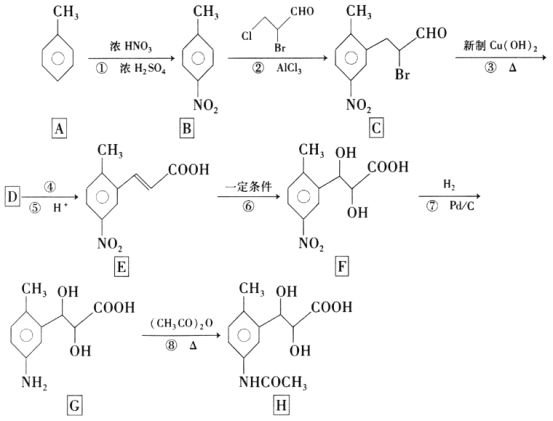
题目内容
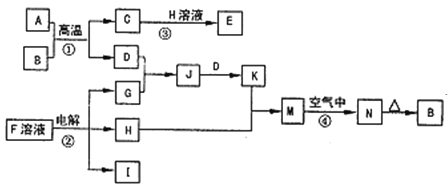
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
【答案】![]() 离子键和共价键 白色沉淀迅速转化为灰绿色,最后变化为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1.28×104kJ 阴 13 4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+
离子键和共价键 白色沉淀迅速转化为灰绿色,最后变化为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1.28×104kJ 阴 13 4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+
【解析】
反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al![]() 2Fe+Al2O3,结合N加热生成B分析判断,则A为Al,B为Fe2O3,反应②是工业上重要的反应之一,分析流程图可知,H为溶液和铝热反应生成的C发生反应,说明H为NaOH,C为Al2O3,D为Fe,G为Cl2;J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,N为红褐色固体,应为Fe(OH)3,反应②是电解F溶液应为NaCl溶液,电解生成NaOH、H2和Cl2气体,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2;
2Fe+Al2O3,结合N加热生成B分析判断,则A为Al,B为Fe2O3,反应②是工业上重要的反应之一,分析流程图可知,H为溶液和铝热反应生成的C发生反应,说明H为NaOH,C为Al2O3,D为Fe,G为Cl2;J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,N为红褐色固体,应为Fe(OH)3,反应②是电解F溶液应为NaCl溶液,电解生成NaOH、H2和Cl2气体,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2;
(1)、分析判断H为NaOH.电子式为:![]() ,氢氧化钠中含有离子键和共价键,故答案为:
,氢氧化钠中含有离子键和共价键,故答案为:![]() ;离子键和共价键;
;离子键和共价键;
(2)、反应④为氢氧化亚铁被空气中的氧气氧化为氢氧化铁的过程,反应现象为白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)、已知I为H2的燃烧热是-285.8kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则1m3(标准状况)H2物质的量=![]() ,完全燃烧,恢复至室温时放出的热量=
,完全燃烧,恢复至室温时放出的热量=![]() ×285.8kJ/mol=1.28×10-4kJ,故答案为:1.28×10-4kJ;
×285.8kJ/mol=1.28×10-4kJ,故答案为:1.28×10-4kJ;
(4)、25℃时,以Pt为电极电解含有少量酚酞的F为NaCl的饱和溶液,阳极电极反应为2Cl--2e-=Cl2↑,阴极电极反应为2H++2e-=H2↑,阴极负附近氢离子浓度减小,氢氧根离子浓度增大,溶液呈红色;若在此极收集到0.2g气体,即生成氢气物质的量为0.1mol,转移电子为0.1mol,所以溶液中增加氢氧根离子物质的量为0.2mol,溶液体积为2L,溶液中氢氧根离子浓度为0.1mol/L,则此时溶液的pH=13,故答案为:阴;13;
(5)、在K为FeCl2溶液中加入与FeCl2等物质的量的Na2O2,恰好使K转化为N为Fe(OH)3,依据氧化还原反应电子守恒和原子守恒写出反应的离子方程式为:4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+,故答案为:4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案