题目内容
【题目】将3.2g铜跟30mL1mol/L的硝酸充分反应,还原产物有NO和NO2,反应后的溶液中有amolH+,则此时溶液中含有NO3-的物质的量为
A. 0.5amol B. (0.1+a)mol C. 0.1amol D. 2amol
【答案】B
【解析】反应后溶液中有amolH+,说明硝酸过量了amol,已知n(Cu)=0.05mol,则生成的Cu(NO3)2中n(NO3—)=0.1mol,所以反应后的溶液中含有n(NO3—)=(0.1+a)mol。所以本题正确答案为B。

【题目】《化学与生活》模块试题
(1)我国农业因遭受酸雨而造成的损失每年高达15亿多元,酸雨是指pH小于________的雨水,这主要是由人为排放的_______和________(填元素名称)的氧化物等酸性气体转化而成的。为治理酸雨的影响,可将CaCO3粉末撒到受酸雨影响的湖泊中,若用离子方程式表示该反应的本质,请完成如下离子反应:CaCO3+2H+==_____________________________。
主食 | 米饭 |
副食 | 红烧鱼 |
饮品 | 豆浆 |
配菜 | ? |
(2)“民以食为天”,人类生命活动所需的各种营养物质主要来自食物。上表制定的食谱中,主食含有的基本营养物质主要是__________,副食含有的基本营养物质主要是_____________;豆浆所属的分散系为__________________。考虑营养成分的均衡搭配,应补充的配菜是__________________。
(3)水是一种宝贵的自然资源。
①生活污水中,经常包括含__________、___________(填元素符号)的化合物,会造成水体植物营养物质污染。水中的氨在微生物的作用下,可被氧化成HNO2,进而氧化成HNO3,写出这一过程的化学方程式____________________________。
②氧化还原法是处理污水常用的方法。某地工厂排放的污水,经检测,污水中含有0.012 mol/L的游离溴,可用Na2SO3还原除去污水中的溴,请写出其化学方程式:___________________________;处理5 L这种污水,至少需加入0.05 mol/L的 Na2SO3 溶液________L才能将溴全部除去。
【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
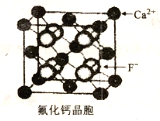
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。