题目内容
以烃和水为原料可以制得CO和H2,如CH4+H2O?CO+3H2.则下列关于甲烷与水反应的说法,正确的是( )
| A、CH4既被氧化又被还原 |
| B、H2O既不是氧化剂又不是还原剂 |
| C、在反应条件下,每消耗1mol H2O必然生成67.2L H2 |
| D、建立平衡后,使用更高效的催化剂,可使H2的产率提高 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:CH4+H2O?CO+3H2中,C元素的化合价由-4价升高为+2价,H元素的化合价由+1价降低为0,以此来解答.
解答:
解:A.C元素的化合价升高,H元素的化合价降低,则CH4既被氧化又被还原,故A正确;
B.水中H元素的化合价降低,水为氧化剂,故B错误;
C.每消耗1mol H2O必然生成3mol氢气.,但状况未知,不能计算其体积,故C错误;
D.催化剂不能影响平衡移动,则不能使H2的产率提高,故D错误;
故选A.
B.水中H元素的化合价降低,水为氧化剂,故B错误;
C.每消耗1mol H2O必然生成3mol氢气.,但状况未知,不能计算其体积,故C错误;
D.催化剂不能影响平衡移动,则不能使H2的产率提高,故D错误;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,选项C为易错点,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
实验室保存下列药品的方法,正确的是( )
| A、氢氟酸贮存在细口玻璃瓶里 |
| B、盛溴的试剂瓶里加一些水来防止溴挥发 |
| C、盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞 |
| D、氯水保存在无色玻璃瓶中;液氯存贮存在钢瓶里 |
下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A、SO2、H2S、Cl2 |
| B、SO2、O2、NH3 |
| C、SO2、CO2、O2 |
| D、HCl、H2S、HI |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+═Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
| A、该装置可能是原电池,可用Cu、C作电极,电解质溶液是盐酸 |
| B、该装置可能是原电池,电解质溶液为硝酸 |
| C、该装置只能是电解池,金属铜为该电解池的阳极,K2SO4为电解质溶液 |
| D、该装置只能是电解池,金属铜为该电解池的阳极,稀H2SO4为电解质溶液 |
下列说法不正确的是( )
| A、人体缺碘会引起大脖子病,缺铁会引起贫血 |
| B、硅是构成一些岩石和矿物的基本元素 |
| C、NaHCO3受热易分解放出CO2,常用于制作糕点 |
| D、将Na2SO4分入钠盐和硫酸盐的分类方法属于树状分类法 |
在下列各溶液中,一定能大量共存的离子组是( )
| A、强酸性溶液中:K+、S2-、ClO-、SO42- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
| D、加入Al能放出H2的溶液中::Na+、K+、CO32-、Cu2+ |
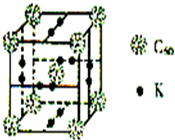 碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题: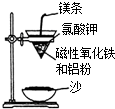 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题: 如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)
如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)