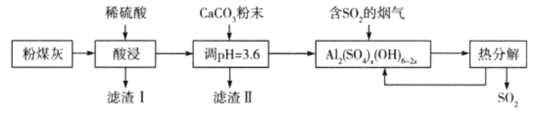
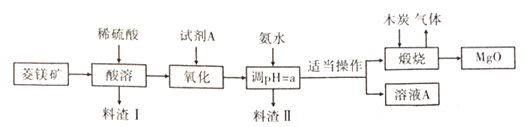
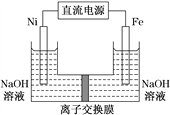
题目内容
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
A. 等质量的NaHCO3和Na2CO3与足量的盐酸反应,产生CO2的质量:Na2CO3多
B. 等质量的NaHCO3和Na2CO3与盐酸反应,产生CO2的速率:NaHCO3快
C. CaCl2溶液加入到NaHCO3溶液中不产生沉淀,加入到Na2CO3溶液中产生白色沉淀
D. 除去Na2CO3固体中混有的少量NaHCO3的最好方法是加热
【答案】A
【解析】
A、碳酸氢钠中碳的质量分数高于碳酸钠,等质量的碳酸钠和碳酸氢钠分别与过量盐酸反应,碳元素全部转化成CO2,所以碳酸氢钠放出的CO2多,故A错误;
B、Na2CO3与盐酸反应需经过:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,而NaHCO3可直接与HCl反应生成气体,故等质量的NaHCO3和Na2CO3与盐酸反应,产生CO2的速率:NaHCO3快,故B正确;
C、CaCl2溶液加入到NaHCO3溶液中不反应,不产生沉淀,而CaCl2溶液加入到Na2CO3溶液中反应产生CaCO3白色沉淀,故C正确;
D、加热时Na2CO3不分解,NaHCO3受热分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,不会引入杂质,故D正确;答案为A。
Na2CO3+CO2↑+H2O,不会引入杂质,故D正确;答案为A。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目