题目内容
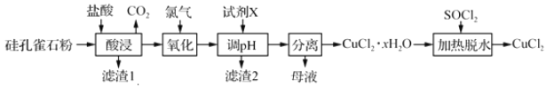
【题目】以硅孔雀石[主要成分为 CuCO3Cu(OH)2、CuSiO32H2O,含 SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
已知:SOCl2+H2O ![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为________________,为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③_________;
(2)滤渣2的主要成分为___________(填化学式);
(3)“氧化”时发生反应的离子方程式为__________________________;
(4)试剂X的作用是调节溶液的pH,试剂X可以是_____;“调pH”时,pH不能过高,其原因是_______________;
A.CuSO4 B.Cu2(OH)2CO3 C.NaOH D.CuO
(5)“加热脱水”时,加入SOCl2的目的是____________________________________。
【答案】CuCO3Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O 适当加快搅拌速率或适当延长酸浸时间或将硅孔雀石粉碎 Fe(OH)3 Cl2+2Fe2+═2Fe3++2Cl﹣ BD 防止Cu2+转化为Cu(OH)2沉淀 生成的HCl抑制CuCl2的水解
【解析】
硅孔雀石的主要成分为 CuCO3Cu(OH)2、CuSiO32H2O,含 SiO2、FeCO3、Fe2O3等杂质,加入足量的盐酸酸浸后,滤渣1为SiO2和H2SiO3; 加入氯气将Fe2+氧化为Fe3+,调整pH将Fe3+变为Fe(OH)3而除去。
(1). “酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为:CuCO3Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O;为提高“酸浸”时铜元素的浸出率,可以采取的措施除了适当提高盐酸浓度、适当提高反应温度外,还可以适当加快搅拌速率或适当延长酸浸时间或将硅孔雀石粉碎等;
(2).滤渣2是 Fe(OH)3;
(3).氧化时,是利用Cl2将Fe2+氧化为Fe3+:Cl2+2Fe2+═2Fe3++2Cl﹣;
(4).试剂X的作用时调节溶液的pH,选择B、D项,是因为A项不能达到调整pH的目的,C项引入了Na+杂质,B、D项具有的共同特点是:能消耗H+,本身难溶而便于添加及后续除去,不引入新的杂质离子;
(5). 加热脱水时,加入SOCl2,是利用SOCl2水解提供HCl氛围,防止Cu2+转化为Cu(OH)2沉淀。

【题目】某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
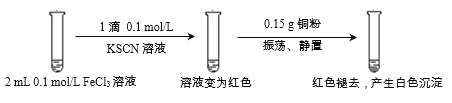
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
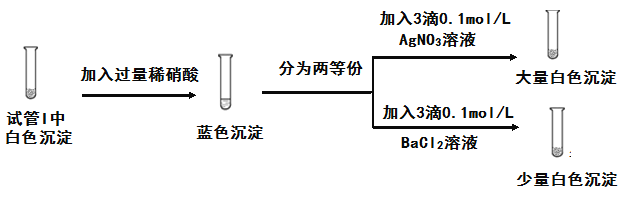
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
I | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 | |
II | 取I中上层清液于试管中,滴加1滴 0.1mol/L KSCN溶液 | 立刻出现红色,同时有白色沉淀生成 |
III | 振荡II中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。