题目内容
【题目】某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20 ℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g·mL-120%的盐酸(20 ℃),搅拌,测量温度T3。
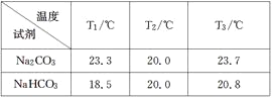
得到下表1的数据:
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是______________________(用离子方程式表示)。
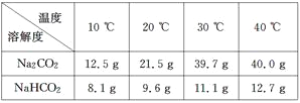
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解____________________________________。
(3)分析表1的数据得出:Na2CO3固体溶于水________,NaHCO3固体溶于水________(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向盛有10 mL水(20 ℃)的烧杯中加入10 mL________,搅拌,测量温度为22.2 ℃。
(5)结合上述探究,下列说法正确的是________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为________(用代数式表示)。
附表:溶解度表
 .
.
【答案】 CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- Na2CO3和NaHCO3固体都是全部溶解 放热 吸热 密度约为1.1 g·mL-120%的盐酸(20 ℃) AC
+OH- Na2CO3和NaHCO3固体都是全部溶解 放热 吸热 密度约为1.1 g·mL-120%的盐酸(20 ℃) AC ![]() ×100%
×100%
【解析】(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,以第一步水解为主,水解离子方程式为:CO32-+H2OHCO3-+OH-,故答案为:CO32-+H2OHCO3-+OH-;
(2)10mL水(20℃)溶解Na2CO3固体质量为:![]() , 10mL水(20℃)溶解NaHCO3固体质量为:
, 10mL水(20℃)溶解NaHCO3固体质量为:![]() ,0.5gNa2CO3、NaHCO3固体都是全部溶解,故答案为:Na2CO3、NaHCO3固体都是全部溶解;
,0.5gNa2CO3、NaHCO3固体都是全部溶解,故答案为:Na2CO3、NaHCO3固体都是全部溶解;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度从20℃升高到23.3℃,放热,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,故答案为:放热;吸热;
(4)强酸溶于水放热,盐酸为强酸,所以需增加探究盐酸溶于水温度的变化,即10mL密度约为1.1g/mL20%的盐酸搅拌,测量温度为22.2℃,故答案为:密度约为1.1g/mL20%的盐酸;
(5)A.盐酸溶于水放热,测量温度为22.2℃,T1/℃,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,两者反应恒温后测量温度T3为20.8℃低于22.2℃,所以NaHCO3与盐酸的反应是吸热反应,故A正确;B.用稀盐酸鉴别NaHCO3和Na2CO3溶液,反应较快的为NaHCO3,能鉴别,故B错误;C.从上述温度变化数值可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关,故C正确.故选AC;
(6)设样品中碳酸氢钠的质量为x.
2NaHCO3![]() Na2CO3+H2O↑+CO2↑ 固体质量减少
Na2CO3+H2O↑+CO2↑ 固体质量减少
168 106 168-106=62
x m1-m2![]()
![]() 样品中碳酸氢钠的质量分数
样品中碳酸氢钠的质量分数![]() ,故答案为:
,故答案为:![]()