题目内容
【题目】在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质 | A | B | C |
初始浓度/mol·L-1 | 1.0 | 2.0 | 0 |
2min时,平衡浓度/mol·L-1 | 0.4 | 0.2 | 1.2 |
请填写下列空白:
(1)该反应方程式可表示为: ;反应达平衡时,A的转化率为___________。
(2)从反应开始到达化学平衡,生成C的平均反应速率为 ;25℃时,反应的化学平衡常数K值(数值)为_____________。
(3)能判断该反应已达到化学平衡状态的依据是__________。
a.容器内压强不变
b.混合气体的密度不变
c.3v正(B)=2v逆(C)
d.c(A)=c(C)
e.混合气体的平均相对分子质量不变
(4)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:
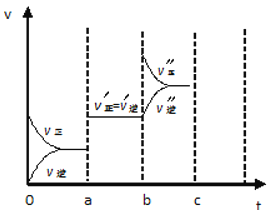
a 点时改变的条件可能是 ;b点时改变的条件可能是 。
(5)如果上述反应起始是按“1 mol A+3 mol B”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号)
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
【答案】
(1)A(g)+3B(g)![]() 2C(g)(1分) 60%(1分)
2C(g)(1分) 60%(1分)
(2)0.6 mol/(L·min)(1分) 4.5×102(1分)(3)ae(2分)
(4)加入催化剂(1分)增加A或B或AB(1分)(5)②④(2分)
【解析】
试题分析:(1)依据图表数据A、B、C的反应浓度分别为:A为1.0mol/L-0.4mol/L=0.6mol/L,B变化的浓度=2.0mol/L-0.2mol/L=1.8mol/L,C的变化浓度=1.2mol/L,反应之比等于化学方程式计量数之比,n(A):n(B):n(C)=0.6:1.8:1.2=1:3:2,反应的化学方程式为A(g) + 3B(g)![]() 2C(g)。平衡后A的转化率=
2C(g)。平衡后A的转化率=![]() ×100%=60%。
×100%=60%。
(2)从反应开始到达化学平衡,C的变化浓度=1.2mol/L,则生成C的平均反应速率=![]() =0.6 mol/(L·min)。平衡常数K=
=0.6 mol/(L·min)。平衡常数K= ![]() =
= ![]() = 450。
= 450。
(3)该反应A(g) + 3B(g)![]() 2C(g)正反应气体系数减小。a.容器内压强不变,说明容器内各物质的总物质的量不变,反应已达到化学平衡状态;b.密度=质量÷体积,混合气体的总质量不变,总体积不变,则密度一直不变,不能判断反应是否已达到化学平衡状态;c.当3v正(B)=2v逆(C)时,正逆反应速率并不相等,反应还没达到化学平衡状态;d.c(A)=c(C),并不意味着浓度保持不变,则不能判断反应是否已达到化学平衡状态;e. 平均相对分子质量=总质量÷总物质的量,混合气体的总质量不变,总物质的量减少,混合气体的平均相对分子质量增大,当混合气体的平均相对分子质量不变时,说明容器内各物质的总物质的量不变,反应已达到化学平衡状态;故选ae。
2C(g)正反应气体系数减小。a.容器内压强不变,说明容器内各物质的总物质的量不变,反应已达到化学平衡状态;b.密度=质量÷体积,混合气体的总质量不变,总体积不变,则密度一直不变,不能判断反应是否已达到化学平衡状态;c.当3v正(B)=2v逆(C)时,正逆反应速率并不相等,反应还没达到化学平衡状态;d.c(A)=c(C),并不意味着浓度保持不变,则不能判断反应是否已达到化学平衡状态;e. 平均相对分子质量=总质量÷总物质的量,混合气体的总质量不变,总物质的量减少,混合气体的平均相对分子质量增大,当混合气体的平均相对分子质量不变时,说明容器内各物质的总物质的量不变,反应已达到化学平衡状态;故选ae。
(4)根据图像可知,ab过程中正逆反应速率都是增大的,但平衡不移动。由于反应是体积减小的可逆反应,所以改变的条件只能是使用了催化剂;bc过程中逆反应速率逐渐增大,而正反应速率突然增大,然后逐渐再降低,平衡向正反应方向移动,所以改变的条件是增加反应物浓度。
(5)由于反应过程中容器容积和温度是不变的,则要使平衡等效,则根据化学方程式换算之后最初的A和B的物质的量必须分别等于1mol和3mol。2molC就相当于是1molA和3molB,题意选项④正也相当于是1molA和3molB,而选项①和③是等效的,因此正确的答案选②④。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案