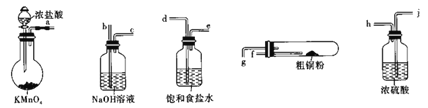
题目内容
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6 gX与Y完全反应后,生成4.4 gR,则 在此反应中,Y与R的化学式量之比为:
A.32: 18 B.16:11 C.8:11 D.16:9
【答案】D
【解析】
试题分析:根据反应X+2Y=R+2M和R和M的摩尔质量之比为22:9,可确定R和M的质量比为22:18,故当反应生成生成4.4gR时,可算出得到M的质量为3.6g,再根据质量守恒定律,化学反应前后质量不变,可直接计算出Y的质量为6.4g,故在此反应中Y和M的化学式量之比=摩尔质量之比=质量之比=6.4g:3.6g=16:9,选D。

【题目】在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质 | A | B | C |
初始浓度/mol·L-1 | 1.0 | 2.0 | 0 |
2min时,平衡浓度/mol·L-1 | 0.4 | 0.2 | 1.2 |
请填写下列空白:
(1)该反应方程式可表示为: ;反应达平衡时,A的转化率为___________。
(2)从反应开始到达化学平衡,生成C的平均反应速率为 ;25℃时,反应的化学平衡常数K值(数值)为_____________。
(3)能判断该反应已达到化学平衡状态的依据是__________。
a.容器内压强不变
b.混合气体的密度不变
c.3v正(B)=2v逆(C)
d.c(A)=c(C)
e.混合气体的平均相对分子质量不变
(4)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:
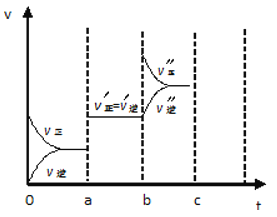
a 点时改变的条件可能是 ;b点时改变的条件可能是 。
(5)如果上述反应起始是按“1 mol A+3 mol B”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号)
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
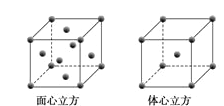
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
【题目】发展以煤制乙烯、丙烯、丁烯等低碳烯烃,部分替代石油化工产品的道路是我国保障能源安全战略的重要措施。间接法是先由煤制合成气(组成为H2、CO和少最的CO2)制备甲醇或二甲醚(CH3OCH3),其主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1 kJmol-1
CH3OH(g) △H1=-90.1 kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H2=-49.0kJmol-1
CH3OH(g) +H2O(g) △H2=-49.0kJmol-1
水煤气变换反应:
③CO(g)+ H2O(g)![]() CO2(g)+ H2(g) △H3=-41.1kJmol-1
CO2(g)+ H2(g) △H3=-41.1kJmol-1
二甲醚合成反应:
④2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H4=-24.5kJmol-1
CH3OCH3(g)+H2O(g) △H4=-24.5kJmol-1
回答下列问题:
(1)分析上述反应(均可逆),发生反应④对于CO转化率的影响是_______(填“增大”、“减小”或“无影响”,其理由是__________。
(2)在二个体积均为1.0L的恒容密闭容器中发生上述二甲醚合成反应④。实验数据见下表:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
①387℃时,反应④的化学平衡常数K=__________。
②达到平衡时,容器b中CH3OH的转化率为________。
③达到平衡时,容器c中CH3OCH3的体积分数为________。
(3)由H2和CO可直接制备二甲醚:2CO2(g)+4H2(g)=CH3OCH(g)+H2O(g) ΔH=__________;为提高反应物的转化率,根据化学反应原理,理论上应采取的措施是________(填序号)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
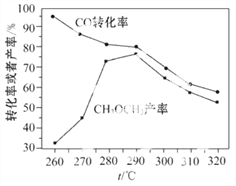
(4)有研究者用Cu-Zn-Al和Al2O3作催化剂,压强为5.0 MPa的条件下,由合成气[![]() =2]直接制备二甲醚,结果如下图所示.已知:选择性=
=2]直接制备二甲醚,结果如下图所示.已知:选择性=![]() ×100%。则有图可知二甲醚的选择性达最大值时对应的温度是____________。
×100%。则有图可知二甲醚的选择性达最大值时对应的温度是____________。
(5)2016年,我国的两个科研团队在合成气直接制备低碳烯烃(nCO+2nH2![]() CnH2n+nH2O)的研究中连续取得重大突破,论文分别发表在《德国应用化学》(2016.03.16)、《Nature》(2016.10.06)杂志上。
CnH2n+nH2O)的研究中连续取得重大突破,论文分别发表在《德国应用化学》(2016.03.16)、《Nature》(2016.10.06)杂志上。![]() =2时,前者在400℃,1MPa的条件下,CO转化率为11%,低碳烯烃选择性达74%;后者在250℃,0.1~0.5MPa的条件下,CO转化率为31.8%,低碳烯烃选择性为60.8%,则其中低碳烯烃的产率较大者的值为_________。
=2时,前者在400℃,1MPa的条件下,CO转化率为11%,低碳烯烃选择性达74%;后者在250℃,0.1~0.5MPa的条件下,CO转化率为31.8%,低碳烯烃选择性为60.8%,则其中低碳烯烃的产率较大者的值为_________。