��Ŀ����
����Ŀ�������ϵĵ�Ԫ�ضԶ�ֲ������Ҫ���ã����а��ĺϳ���Ӧ���ǵ�ǰ���о��ȵ㡣
��1����ͬ�¶��¹�ҵ�ϳɰ�N2(g)+3H2(g)![]() 2NH3(g)��Ӧ�IJ���Kֵ���±���
2NH3(g)��Ӧ�IJ���Kֵ���±���
�¶�/�� | 25 | 400 | 450 |
K | 5��108 | 0.507 | 0.152 |
�ٹ�ҵ�ϳɰ���Ӧƽ�ⳣ������ʽΪK=___��
������ƽ�ⳣ�����ͣ��÷�ӦΪ���ȷ�Ӧ������___��
�۴�ƽ���ӽǿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��___��
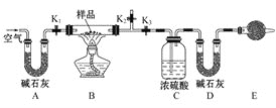
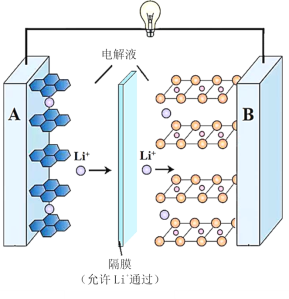
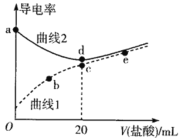
��2����ѧ�����õ�ⷨ�ڳ��³�ѹ��ʵ�ֺϳɰ�������ʱ����������ʾ��ͼ��ͼ�����е��ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ���
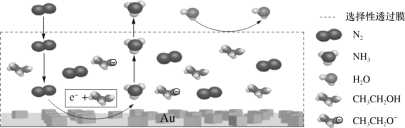
������������NH3�ĵ缫����ʽΪ___��
������˵������ȷ����___������ĸ��ţ���
a.��������﮵���������ǿ������
b.��װ���ý�(Au)������Ŀ���ǽ���N2�ļ���
c.ѡ������Ĥ������N2��NH3ͨ������ֹH2O����װ��
���𰸡�![]() ���¶����ߣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�����Ӧ����Ϊ���ȷ�Ӧ �����ʽǶȿ��ǣ����¸��ã��Ӵ����Ƕȿ��ǣ�500�����Ҵ������Ը��� N2+6e-+6C2H5OH=2NH3+6C2H5O- b
���¶����ߣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�����Ӧ����Ϊ���ȷ�Ӧ �����ʽǶȿ��ǣ����¸��ã��Ӵ����Ƕȿ��ǣ�500�����Ҵ������Ը��� N2+6e-+6C2H5OH=2NH3+6C2H5O- b
��������
1���ٻ�ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ������Ũ����֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ��
�������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����ɱ������ݿ�֪�������¶ȣ��ϳɰ���Ӧƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���
�ۺϳɰ���Ӧ�У���Ӧ�¶�Խ�ߣ���Ӧ����Խ�죬���Ǹ÷�ӦΪ���ȷ�Ӧ���¶ȸ�ת���ʻή�ͣ�������500�����Ҵ���������ߣ����ԴӴ������Ե��ۺ����ؿ���ѡ��500�����Һ��ʣ�
��2����������������ʾ��ͼ��֪��������N2ת��ΪNH3��C2H5OHת��ΪC2H5O-���ӣ�˵��N2��C2H5OH�����£��������õ����ӷ�����ԭ��Ӧ����NH3��
��a. ���ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ�����������������ӻ�������ṩ���ӣ�
b.�����ܽ��ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ����ܽ��ͷ�Ӧ��ļ��ܣ�
c.��ͼ��֪��ˮ��ѡ������Ĥ���Ϸ���
��1������ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ������Ũ����֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ����ҵ�ϳɰ���Ӧƽ�ⳣ������ʽΪK=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����ɱ������ݿ�֪�������¶ȣ��ϳɰ���Ӧƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ�����ϳɰ���ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����¶����ߣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�����Ӧ����Ϊ���ȷ�Ӧ��
���ϳɰ���Ӧ�У���Ӧ�¶�Խ�ߣ���Ӧ����Խ�죬���Ǹ÷�ӦΪ���ȷ�Ӧ���¶ȸ�ת���ʻή�ͣ�������500�����Ҵ���������ߣ����ԴӴ������Ե��ۺ����ؿ���ѡ��500�����Һ��ʣ��ʴ�Ϊ�������ʽǶȿ��ǣ����¸��ã��Ӵ����Ƕȿ��ǣ�500�����Ҵ������Ը��ߣ�
��2����������������ʾ��ͼ��֪��������N2ת��ΪNH3��C2H5OHת��ΪC2H5O-���ӣ�˵��N2��C2H5OH�����£��������õ����ӷ�����ԭ��Ӧ����NH3���缫��ӦʽΪN2+6e-+6C2H5OH=2NH3+6C2H5O-���ʴ�Ϊ��N2+6e-+6C2H5OH=2NH3+6C2H5O-��
��a. ���ҺΪ�ܽ�����������﮺��Ҵ��Ķ����л��ܼ�����������������ӻ�������ṩ���ӣ���ǿ���Һ�ĵ����ԣ���a��ȷ��
b.�����ܽ��ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ����ܽ��ͷ�Ӧ��ļ��ܣ���װ���ý�(Au)������Ŀ���ǽ���N2�Ļ�ܣ� ��b����
c.��ͼ��֪��ˮ��ѡ������Ĥ���Ϸ���˵��ѡ������Ĥ������N2��NH3ͨ������ֹH2O����װ�ã���c��ȷ��
�ʴ�Ϊ��b��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�