题目内容
1.将铁粉投入到盛有Cu2+、Ag+、Fe3+的溶液中,反应完毕时,若烧杯底部有铁粉剩余,溶液中一定不含的金属离子是Ag+、Fe3+、Cu2+,若烧杯中没有铁粉剩余,则溶液中一定含有的金属离子是Fe2+,若溶液中不含有Cu2+时,则一定不含有的金属离子是Ag+和Fe3+.分析 三种离子的氧化性:Ag+>Fe3+>Cu2+,多种氧化剂跟一种还原剂发生反应,要注意氧化剂的氧化性顺序.氧化性较强的氧化剂首先跟还原剂发生反应,直至这种氧化剂被消耗完;另一种氧化剂再接着跟还原剂发生反应,依此类推,直至还原剂消耗完,据此解答.
解答 解:因为在Ag+、Fe3+、Cu2+中三种离子的氧化性顺序为Ag+>Fe3+>Cu2+,当加入铁粉时,按Ag+、Fe3+、Cu2+的顺序反应,当铁粉剩余时,Ag+、Fe3+、Cu2+将全部反应;若铁粉不剩余时,溶液中一定含有的离子只有Fe2+,溶液中不含Cu2+时,因为Fe3+、Ag+的氧化性比Cu2+强,所以一定不再有Ag+和Fe3+;
故答案为:Ag+、Fe3+、Cu2+;Fe2+;Ag+和Fe3+.
点评 本题考查了氧化还原反应的规律,熟悉三种离子的氧化性强弱及氧化还原反应的先后规律即可解答,题目难度不大.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
16.下列物质与其用途相符合的是( )
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④⑤ | D. | 全部 |
6.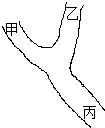 “Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )
“Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )
 “Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )
“Y”型河流上游有甲和乙两家化工厂,它们生产时都向河流排放废水.经检测,两家化工厂排出污水工有6种离子:①K+、②Ag+、③Fe3+、④Cl-、⑤OH-、⑥NO3-.某化学兴趣小组在河流下游丙处做离子检测实验,你认为该处一定可以检测到的离子是( )| A. | ①和⑥ | B. | ①③⑥ | C. | ①③④⑥ | D. | ①②③④⑤⑥ |
13.下列离子方程式书写不正确的是( )
| A. | 向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O | |
| B. | 小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| C. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| D. | 检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+ |
10.下列条件下,两种气体的分子数一定相等的是( )
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H4和NO | ||
| C. | 同温度同压强的CO和N2 | D. | 同体积同压强的N2和N2H4 |
11.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( )
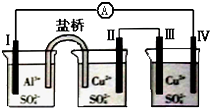

| A. | 电极Ⅱ逐渐溶解 | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电流方向:电极Ⅰ→A→电极Ⅳ | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |