题目内容
【题目】元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是

A. q的溶液显酸性
B. W的氧化物常温常压下为液态
C. p不能使酸性高锰酸钾溶液褪色
D. Z的氧化物的水化物一定为强酸
【答案】D
【解析】元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物,m、n分别是元素Y、Z的单质,n通常为深红棕色液体,n为Br2,0.01mol/L r溶液的pH为2,r为强酸,则r为HBr,p被英国科学家法拉第称为“氢的重碳化合物”,p为C6H6,s通常是难溶于水、比水重的油状液体,s为溴苯,q为FeBr3,m为Fe。由上述分析可知,W为H,X为C,Y为Fe,Z为Br。A.q为FeBr3,铁离子水解,溶液显酸性,故A正确;B.W的氧化物为水,常温常压下为液态,故B正确;C.p为C6H6,苯分子中没有碳碳双键,不能使酸性高锰酸钾溶液褪色,故C正确;D.Z的氧化物的水化物若为HBrO4时为强酸,若为HBrO时为弱酸,故D错误;故选D。

【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
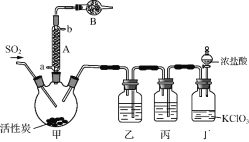
(1) 仪器A冷却水的进口_______(填“a”或“b”)。
(2) 仪器B中盛放的药品是_______。
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为_______,以下与二氧化硫有关的说法中正确的是_______。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为_______,若缺少装置乙,则硫酰氯会损失,该反应的化学方程为______________。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是______________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)____。
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
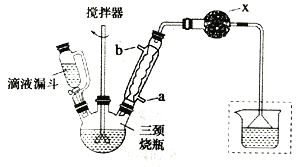
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。





