题目内容
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1)
2NH3(g) △H=-92.4 kJ·mol-1)
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 4 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
下列说法正确的是
A.c1<c2<2 c1 B.a+b>92.4 C.α1 +α2=1 D.ρ2=2ρ1
BD
解析试题分析:为了便于分析,构建了甲、丙、丁两三个等效平衡。
A、平衡后丁加压为乙,平衡逆向移动,NH3的浓度变大,故有c2>2 c1,错误;B、设丙到平衡状态吸收的能量为c,则有a+c=92.4,因为乙的NH3的量多,反应的多,吸收的热量多,故有a+b>92.4,正确;C、设丙的转化率为α3,,则有α1 +α3=1,乙的转化率低于丙,故α1 +α2<1,错误;D、甲与乙的体积相等,质量乙是甲的两倍,故 ρ2=2ρ1,正确。
考点:考查化学平衡的移动的知识。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案已知 (CH3COOH)2 (g)  2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(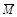 =
= )随温度(T)的变化曲线如图所示,下列说法正确的是
)随温度(T)的变化曲线如图所示,下列说法正确的是
| A.该过程的△H < 0 |
| B.气体压强:P(a) < P(b) = P(c) |
| C.平衡常数:K(a) =" K(b)" < K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是
A.101KPa、120℃时,该反应的平衡常数表达式 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
以下对反应过程的分析和判断正确的是
A. 反应在前50 s的平均速率为v(PCl3)="0.0032" mol·L-1·s-1
B.保持其他条件不变,若升高温度,平衡时,c(PCl3)="0.11" mol·L-1,则反应为放热反应
C. 相同温度下,若起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,则达平衡前v(正)>v(逆)
D.相同温度下,若起始时向容器中充入2.0molPCl3、2.0molCl2,则达平衡时,PCl3的转化率大于80%
在密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是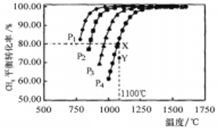
| A.上述反应的△H>0 |
| B.压强P1>P2>P3>P4 |
| C.1100℃该反应的平衡常数为64mol2·L-1 |
| D.压强为P4时,在Y点:v(正)<v(逆) |
化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述叙述正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②表示压强对可逆反应2A(g)+B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.据图④,若除去0.1mol·L-1CuSO4溶液中的Fe3+可向溶液中加入适量NaOH至pH约为5 |
下列说法正确的是
| A.常温下,中和pH与体积均相同的盐酸和醋酸消耗NaOH的物质的量相同 |
| B.纯铁和生铁在酸雨中均发生电化学腐蚀 |
| C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生 |
| D.食品工业用NaHCO3作焙制糕点的膨松剂 |
为了探索外界条件对反应:aX(g)+bY(g) cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
| A.△H<0,a+b>c |
| B.△H>0,a+b<c |
| C.△H>0,a+b>c |
| D.△H<0,a+b<c |