题目内容
已知反应2D+E 3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
| A.pH=6.8时,D的浓度(mg/L)一定最大 |
| B.在pH相同的条件下,增大压强,D的浓度(mg/L)增大 |
| C.调节pH到8.8,可使该反应正、逆反应速率都为0 |
| D.温度相同时,不同pH条件下,该反应的平衡常数相同 |
D
解析试题分析: A、各pH条件下, 不同时刻,D的浓度不同,pH为6.8时,不一定D的浓度就最大,错误;B、该反应中各物质的状态未知,增大压强,平衡不一定是逆向移动,错误;C、按图像所示,调节pH到8.8时,D的浓度不发生明显变化,但此时可能是平衡状态,正逆反应速率相等,但不为0,错误;D、温度相同,其他条件不同,同一可逆反应的平衡常数相同,正确。
考点:考查化学反应速率、化学平衡知识。

在密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
| A.上述反应的△H>0 |
| B.压强P1>P2>P3>P4 |
| C.1100℃该反应的平衡常数为64mol2·L-1 |
| D.压强为P4时,在Y点:v(正)<v(逆) |
在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
| A.反应物浓度:a点小于c点 |
| B.c点时反应进行的程度最大 |
| C.该反应的正反应为吸热反应 |
| D.△t1=△t2时,生成H2的物质的量:a~b段小于b~c段 |
已知 (CH3COOH)2 (g)  2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(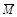 =
= )随温度(T)的变化曲线如图所示,下列说法正确的是
)随温度(T)的变化曲线如图所示,下列说法正确的是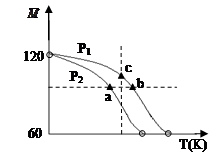
| A.该过程的△H < 0 |
| B.气体压强:P(a) < P(b) = P(c) |
| C.平衡常数:K(a) =" K(b)" < K(c) |
| D.测定乙酸的相对分子质量要在高压、低温条件 |
下列原理和定律中,可用于判断化学平衡移动方向的是
| A.盖斯定律 | B.阿伏加德罗定律 | C.勒夏特列原理 | D.质量守恒定律 |
COCl2(g) CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
下列图示与对应的叙述相符的是 ( )



图1 图2 图3 图4
A.图1表示可逆反应“2X(g) Y(g)△H <0”,温度T1<T2的情形 Y(g)△H <0”,温度T1<T2的情形 |
| B.用0.1000 mol·L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图2曲线可确定①的酸性最强 |
C.在其它条件不变时,2SO2(g) +O2(g)  2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率 |
| D.图4表示碳酸钙与盐酸反应收集到气体最多的时间段是t3~t4 |
最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是
A.101KPa、120℃时,该反应的平衡常数表达式 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述叙述正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②表示压强对可逆反应2A(g)+B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.据图④,若除去0.1mol·L-1CuSO4溶液中的Fe3+可向溶液中加入适量NaOH至pH约为5 |