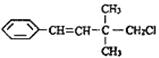
题目内容
【题目】向Mg、Al、Fe 三种金属粉末状混合物中,加人过量盐酸充分反应,过滤后向滤液中加入过量NaOH溶液充分反应,再过滤后滤液中存在的离子有
A. Al3+ B. Cu2+ C. Mg2+ D. AlO2-
【答案】D
【解析】镁、铝、铁三种金属粉末混合物,加入过量盐酸充分反应,发生Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+、Fe+2H+=Fe2++H2↑,过滤后向滤液中加入过量氢氧化钠溶液,发生H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O,镁、铁都生成沉淀,铝元素存在于AlO2-中,故选D。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
【题目】现有六种短周期元素,原子序数逐渐增大。请根据以下信息,用元素符号回答下列问题:
L | 原子中只有一个电子 |
M | 原子的最外层电子数是次外层电子数的2倍 |
N | 地壳中含量最多的元素 |
Q | 所在的周期数是族序数的3倍 |
R | R2+具有与氖原子相同的电子层结构 |
T | 最高正化合价与最低负化合价的代数和为6 |
(1)写出这两种元素的名称:M_________、Q________。
(2)T在周期表中的位置是______,T的原子结构示意图为_______,T的最高价氧化物对应水化物的化学式为_______。
(3)上述六种元素中原子半径最大的是__________,非金属性最强的是____________。
(4)写出MN2的电子式_________,用电子式表示化合物RT2的形成过程:______________。