题目内容
【题目】现有六种短周期元素,原子序数逐渐增大。请根据以下信息,用元素符号回答下列问题:
L | 原子中只有一个电子 |
M | 原子的最外层电子数是次外层电子数的2倍 |
N | 地壳中含量最多的元素 |
Q | 所在的周期数是族序数的3倍 |
R | R2+具有与氖原子相同的电子层结构 |
T | 最高正化合价与最低负化合价的代数和为6 |
(1)写出这两种元素的名称:M_________、Q________。
(2)T在周期表中的位置是______,T的原子结构示意图为_______,T的最高价氧化物对应水化物的化学式为_______。
(3)上述六种元素中原子半径最大的是__________,非金属性最强的是____________。
(4)写出MN2的电子式_________,用电子式表示化合物RT2的形成过程:______________。
【答案】碳 钠 第三周期 VIIA  HClO4 Na O
HClO4 Na O ![]()
![]()
【解析】
L原子中只有一个电子,则L为H元素;M原子的最外层电子数是次外层电子数的2倍,则核外有2个电子层,电子数分别是2和4,M为C元素;N为地壳中含量最多的元素,则N为O;Q所在的周期数是族序数的3倍,又属于短周期元素,则Q的周期数为3,族序数为1,推出Q为Na元素;R2+具有与氖原子相同的电子层结构,则R为第三周期元素,核外最外层电子数为2,即R为Mg元素;T的最高正化合价与最低负化合价的代数和为6,绝对值之和为8,则T的最高正化合价位+7,位于VIIA族,短周期元素中T为Cl元素,再结合元素周期表与元素周期律,物质的结构与性质作答。
根据上述分析可知,L、M、N、Q、R和T分别是H、C、O、Na、Mg和Cl,则
(1)M为碳元素,Q为Na钠元素,
故答案为:碳;钠;
(2)T为Cl,根据上述分析可知,最高正化合价=族序数,位于第三周期 VIIA族,核外电子层为3层,其原子结构示意图为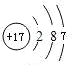 ,其最高价氧化物对应水化物的化学式为HClO4,
,其最高价氧化物对应水化物的化学式为HClO4,
故答案为:第三周期 VIIA族; ;HClO4;
;HClO4;
(3)原子的电子层数越少,其原子半径越小;同一周期元素中,原子半径随着原子序数增大而减小,则上述六种元素中原子半径最大的是Na;同主族中从上到下元素的非金属性依次减弱,同一周期中从左到右元素非金属性依次增强,则上述六种元素中非金属性最强的是O,
故答案为:Na;O;
(4)MN2为二氧化碳,为共价化合物,分子内含碳氧共价双键,其电子式为:![]() ,RT2为氯化镁,是离子化合物,用电子式表示其形成过程为:
,RT2为氯化镁,是离子化合物,用电子式表示其形成过程为:![]() ,
,
故答案为:![]() ;
;![]() 。
。