题目内容
【题目】I已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1
O2(g)═H2O(l);△H=-285.8kJmol-1
②H2(g)+![]() O2(g)═H2O(g);△H=-241.8kJmol-1
O2(g)═H2O(g);△H=-241.8kJmol-1
③CO(g)═C(s)+![]() O2(g);△H=+110.5kJmol-1
O2(g);△H=+110.5kJmol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________
(2)H2的燃烧热△H=___________________
(3)燃烧10gH2生成液态水,放出的热量为________________
(4)表示CO燃烧热的热化学方程式为.________________
II已知:(1)P4(s,白磷)+5O2(g)==P4O10(s)△H1=-2983.2kJ/mol
(2)P(s,红磷)+ ![]() O2(g)=
O2(g)= ![]() P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
【答案】①②④ -285.8kJmol-1 1429KJ C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1 P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol 红磷 低
【解析】
I (1)根据热化学方程式中△H的符号判断;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(3)根据物质的量之比等于热量比求算;
(4)结合盖斯定律计算得到,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
II根据盖斯定律进行求算;物质的能量越低越稳定。
I (1)由已知热化学方程式中△H的符号可知,四个反应的△H①②④均为负值,即都是放热反应;③的为正值,即为吸热反应;
故答案为:①②④;
(2) H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1,依据燃烧热概念可知H2的燃烧热△H= -285.8kJmol-1;
O2(g)═H2O(l);△H=-285.8kJmol-1,依据燃烧热概念可知H2的燃烧热△H= -285.8kJmol-1;
(3) H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1,燃烧10g H2的物质的量为5mol ,则燃烧10g H2生成液态水,放出的热量为285.8
O2(g)═H2O(l);△H=-285.8kJmol-1,燃烧10g H2的物质的量为5mol ,则燃烧10g H2生成液态水,放出的热量为285.8![]() 5= 1429.0kJ ;
5= 1429.0kJ ;
(4) ③CO(g)═C(s)+![]() O2(g);△H=+110.5kJmol-1
O2(g);△H=+110.5kJmol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1
依据盖斯定律④+③得到CO(g)+ ![]() O2(g)=CO2(g) △H = - 283.0kJ/mol;CO燃烧热的热化学方程式为CO(g)+
O2(g)=CO2(g) △H = - 283.0kJ/mol;CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)=CO2(g) △H = - 283.0kJ/mol;
O2(g)=CO2(g) △H = - 283.0kJ/mol;
II红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:(1)P4O10(s)=P4(s、白磷)+5O2(g);△H=2983.2kJ/mol;
(2)4P(s、红磷)+5O2(g)=P4O10(s);△H=-738.5×4kJ/mol=-2954kJ/mol;
根据盖斯定律,红磷转化为白磷4P(s、红磷)=P4(s、白磷)的△H=2983.2kJ/mol-2954kJ/mol=+29.2kJ/mol;
故答案为:4P(s、红磷)=P4(s、白磷)△H=+29.2kJ/mol;
相同的状况下,能量较低的是红磷;能量越低越稳定,则白磷的稳定性比红磷低。

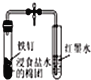
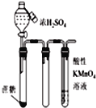
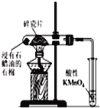
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 溶液橙色变深 | 增大生成物浓度,平衡 |
B | 向较浓的 |
|
|
C | 取 | 溶液中出现砖红色 | 淀粉完全水解 |
D | 分别向 | 加入 | 反应物的浓度越大,反应速率越快 |
A.AB.BC.CD.D