题目内容
15.红磷P(s)和O2(g)发生反应生成P2O3(s)和P2O5(s),反应过程与能量关系如图所示(图中a、b、c均大于0),请结合途中数据填写: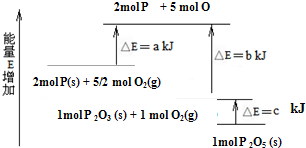
(1)P(s)和O2(g)反应生成P2O3(s)的热化学方程式2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=(a-b)KJ/mol.
(2)P2O5(s)分解成P2O3(s)和O2(g)的热化学方程式P2O5(s)=P2O3(s)+O2(g)△H=+cKJ/mol.
(3)红磷P(s)的燃烧热为△H=-$\frac{b+c-a}{2}$KJ/mol.
(4)P(s)和O2(g)分两步反应生成1mol P2O5(s)的△H1与P(s)和O2(g)一步反应生成1mol P2O5(s)的△H2关系是:△H2=△H1(填“<”、“>”或“=”).
(5)6.2g的单质磷P在6.4g氧气中燃烧至反应物耗尽,放出0.1b+0.05c-0.1a kJ热量.
分析 (1)反应能量转化可知,2molP(s)和$\frac{3}{2}$molO2(g)反应生成1molP2O3(s)放热(a-b)KJ,结合热化学方程式书写方法写出,标注物质聚集状态;
(2)图象分析可知,1molP2O3(s)和1molO2(g)反应生成1molP2O5(s)放出热量cKJ,所以1molP2O5(s)分解成1molP2O3(s)和1molO2(g),反应吸收热量为cKJ;
(3)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,结合热化学方程式和盖斯定律计算得到燃烧的热化学方程式;
(4)依据盖斯定律可知,反应一步进行或几步进行,反应的焓变不变,P(s)和O2(g)分两步反应生成1mol P2O5(s)的△H1与P(s)和O2(g)一步反应生成1mol P2O5(s)的△H2关系是相同;
(5)6.2g的单质磷P物质的量=$\frac{6.2g}{31g/mol}$=0.2mol,在6.4g氧气物质的量=$\frac{6.4g}{32g/mol}$=0.2mol,磷在氧气中燃烧至反应物耗尽生成P2O5(s),结合热化学方程式计算得到;
解答 解:(1)2molP(s)和$\frac{3}{2}$molO2(g)反应生成1molP2O3(s)放热(a-b)KJ,结合热化学方程式书写方法写出2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=(a-b)KJ/mol,
故答案为:2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=(a-b)KJ/mol;
(2)图象分析可知,1molP2O3(s)和1molO2(g)反应生成1molP2O5(s)放出热量cKJ,所以1molP2O5(s)分解成1molP2O3(s)和1molO2(g),反应吸收热量为cKJ,反应的热化学方程式为:P2O5(s)=P2O3(s)+O2(g)△H=+cKJ/mol,
故答案为:P2O5(s)=P2O3(s)+O2(g)△H=+cKJ/mol;
(3)红磷P(s)的燃烧热是指1mol红磷P(s)完全燃烧生成稳定氧化物P2O5(s)放出的热量,图象中分析结合热化学方程式:
①2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=(a-b)KJ/mol;
②P2O5(s)=P2O3(s)+O2(g)△H=+cKJ/mol
依据盖斯定律计算(①-②)×$\frac{1}{2}$得到P(s)+$\frac{5}{4}$O2(g)=$\frac{1}{2}$P2O5(s)△H=-$\frac{b+c-a}{2}$KJ/mol,
故答案为:△H=-$\frac{b+c-a}{2}$KJ/mol;
(4)反应一步进行或几步进行,反应的焓变不变,P(s)和O2(g)分两步反应生成1mol P2O5(s)的△H1与P(s)和O2(g)一步反应生成1mol P2O5(s)的△H2关系是相同,
故答案为:=;
(5)6.2g的单质磷P物质的量=$\frac{6.2g}{31g/mol}$=0.2mol,在6.4g氧气物质的量=$\frac{6.4g}{32g/mol}$=0.2mol,磷在氧气中燃烧至反应物耗尽生成P2O5(s),结合热化学方程式可知磷过量
①2P(s)+$\frac{3}{2}$O2(g)=P2O3(s)△H=(a-b)KJ/mol=-(b-a)KJ/mol;
2 $\frac{3}{2}$ 1 (b-a)KJ
0.2 0.15 0.1(b-a)KJ
②P2O3(s)+O2(g)=P2O5(s)△H=-cKJ/mol
1 cKJ
0.2-0.15 0.05cKJ
共发出热量=0.1(b-a)KJ+0.05cKJ=(0.1b+0.05c-0.1a)KJ;
故答案为:0.1b+0.05c-0.1a.
点评 本题考查反应热的计算,能量变化特征分析,难度不大,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | 硫化亚铁溶于稀硝酸中的离子方程式为:FeS+2H+═Fe2++H2S↑ | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+能够大量共存 |
| A. |  称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值.
| A. | ②③⑤ | B. | ①②③ | C. | ②③④⑥ | D. | ①③④⑤ |
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 原混合物在反应后,被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 原混合物在反应后,被还原的硝酸与未被还原的硝酸之比为1:5 |

| A. | 12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g)△H=-221 kJ | |
| C. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |