题目内容
下图是元素周期表的一部分,下列说法中正确的是
| A.元素①位于第二周期第ⅣA族 |
| B.气态氢化物的稳定性:④>② |
| C.最高价氧化物对应水化物酸性:⑤>④ |
| D.元素的最高正化合价:③=⑤ |
C
解析试题分析:A.元素①位于第二周期第ⅤA族。错误。B.②是O元素,④是S元素。在同一主族的元素中,从上到下。随着原子序数的增大,元素的非金属性逐渐减弱,其对于的气态氢化物的稳定性逐渐减弱。所以气态氢化物的稳定性:②>④。错误。C.④是S,⑤是Cl。他们是同一周期的元素,对于同一周期的元素,随着原子序数的增大,元素的非金属性逐渐增强,元素的最高价氧化物对应水化物酸性也逐渐增强。由于非金属性:Cl>S,所以酸性:HClO4>H2SO4.正确。D.元素③是F,元素⑤是Cl。由于F是非金属性最强的元素,其 最高化合价为0价,Cl元素的最高正化合价为+7价。故最高正化合价不相等。错误。
考点:考查元素周期表、元素周期律的知识及应用。

根据中学化学教材所附元素周期表判断,下列叙述正确的是
| A.L电子层电子数为奇数的所有元素都是非金属 |
| B.第3、4、5、6周期元素的数目分别是8、18、32、32 |
| C.由左至右第8、9、10三列元素中没有非金属元素 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如右图所示。下列说法正确的是( )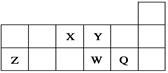
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.元素Y、W的气态氢化物的稳定性,前者比后者差 |
| C.离子Y2-和Z3+的离子半径,后者比前者大 |
| D.元素W的最高价氧化物对应的水化物酸性比Q的强 |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.R氢化物的沸点高于Y氢化物的沸点 |
| B.R元素基态原子与W元素基态原子未成对电子数相同 |
| C.W与Y形成的化合物能与强碱溶液反应,但不能与任何酸反应 |
| D.R与Y形成的化合物和W与Y形成的化合物的晶体类型相同 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
| A.由mXa+与nYb-,得m+a=n-b |
| B.X2-的还原性一定大于Y- |
| C.X,Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
同主族常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为:HXO4<HYO4<HZO4,下列判断不正确的是
| A.Y单质可以在海水中提取 | B.离子半径: X->Y- |
| C.气态氢化物稳定性:HX<HZ | D.单质氧化性: Y>Z |
下列说法正确的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
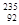 U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。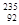 U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关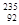 U说法正确的是( )
U说法正确的是( )
A.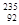 U原子核中含有92个中子 U原子核中含有92个中子 | B.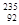 U原子核外有143个电子 U原子核外有143个电子 |
C.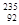 U与 U与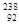 U互为同位素 U互为同位素 | D.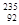 U与 U与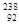 U互为同素异形体 U互为同素异形体 |
柳州的龙江河铬污染事故再一次令人触目惊心,环境保护刻不容缓。下列关于铬的一种原子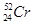 说法正确的是
说法正确的是
A.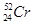 与 与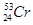 互为同素异形体 互为同素异形体 |
B.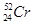 含有24个中子 含有24个中子 |
C.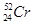 与 与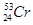 互为同位素,物理性质、化学性质均相同 互为同位素,物理性质、化学性质均相同 |
D.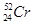 中子数比电子数多4个 中子数比电子数多4个 |