题目内容
下列说法正确的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
C
解析试题分析:A、HF、HCl、HBr、HI中HF分子间形成氢键,HF沸点最高,错误;B、金属与非金属元素形成的化合物也有可能为共价化合物,如AlCl3,错误;C、N原子与3个Cl分别形成一个共价键,N原子和Cl原子均达到8电子稳定结构,正确;D、NaHSO4晶体中阳离子为Na+,阴离子为HSO4?,个数比为1:1,熔化时只破坏离子键,错误。
考点:本题考查物质性质的递变性、化学键、原子结构。

练习册系列答案
相关题目
基态原子的价电子构型3s23p3,下列关于它的描述正确的是
| A.该元素的电负性小于1.8 |
| B.3p能级上的3个电子能量相等,自旋状态相同 |
| C.它的氢化物分子中有四个键合电子 |
| D.该元素的价电子数是4 |
下列关于物质的结构与性质的说法正确的是
| A.熔点:MgBr2<SiCl4<BN |
| B.冰和干冰均为分子晶体,冰的沸点、密度都高于干冰 |
| C.第ⅤA族元素的几种气态氢化物中,NH3是稳定性最高的氢化物 |
| D.同周期ⅦA族元素的氧化物对应水化物的酸性一定强于ⅥA族 |
下图是元素周期表的一部分,下列说法中正确的是
| A.元素①位于第二周期第ⅣA族 |
| B.气态氢化物的稳定性:④>② |
| C.最高价氧化物对应水化物酸性:⑤>④ |
| D.元素的最高正化合价:③=⑤ |
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且
M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是( )
| A.X分别和其它四种元素均可形成至少2种化合物 |
| B.M分别和W、X、Y、Z形成化合物,均显相同化合价 |
| C.M、X、Z三种元素组成的化合物含有离子键 |
| D.M、X、Y组成化合物和Y、Z组成化合物,其等物质的量浓度的水溶液中由水电离出的氢离子浓度相同 |
甲、乙、丙、丁4种物质均为含有两种元素的化合物,其分子均含有18个电子,下列说法正确的是( )
| A.若气体甲的水溶液在常温下的pH<7,则甲一定是HCl |
| B.若气体乙的摩尔质量与O2相同,则乙一定是N2H4 |
| C.若3.0g丙的物质的量为0.1mol,则丙一定是甲烷的同系物 |
| D.若丁为四原子分子,则丁一定能使品红溶液褪色 |
元素周期表中铋元素的数据见图,下列说法正确的是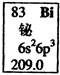
| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |
下列说法正确的是( )
| A.常温常压下,只有一种元素的单质呈液态 |
| B.元素周期表中所有元素都是从自然界中发现的 |
| C.过渡元素不全是金属元素 |
| D.常温常压下,气态单质的分子都是由非金属元素的原子形成的 |