题目内容
(2010?崇文区一模)如图1为某套实验装置示意图,其中加热装置和部分药品等已经省略(装置①和装置②为气体发生装置).
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质.装置①用于实验室制备NH3,用装置②制备过量O2.A装置中相应药品在催化加热时发生反应的化学方程式是
(2)乙同学利用图2所示装置合成SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是
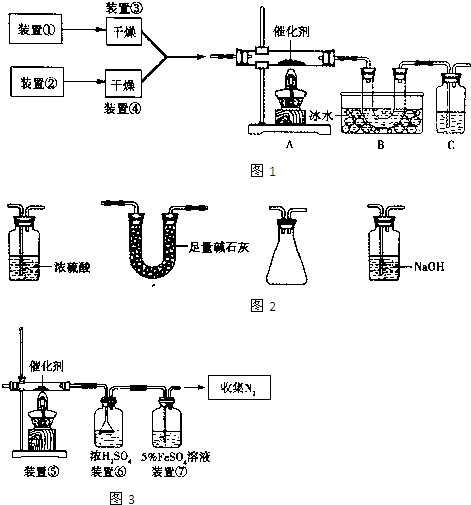
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦.
请回答:装置⑦的作用可能是
×100%=90%
×100%=90%(能正确表达出计算过程即可)
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质.装置①用于实验室制备NH3,用装置②制备过量O2.A装置中相应药品在催化加热时发生反应的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因
| ||
| △ |
因为2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅
因为2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅
.(2)乙同学利用图2所示装置合成SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是
Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O
Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O
(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进将e、m依次连接在B、C之间或将C装置换成f
将e、m依次连接在B、C之间或将C装置换成f
(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦.
请回答:装置⑦的作用可能是
吸收未反应的NO
吸收未反应的NO
;若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016ml N2,则NO的转化率是| 2016×6 |
| 2688×5 |
| 2016×6 |
| 2688×5 |
分析:(1)氨气催化氧化反应生成一氧化氮和水,据此书写化学反应方程式;一氧化氮易被氧气氧化成红棕色的二氧化氮,所以B处冰水冷却的U型管中有红棕色气体生成,二氧化氮中存在一个平衡,会转化为无色的四氧化二氮,温度降低,平衡向正反应方向移动,所以,U型管底部颜色越浅;
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,据此书写化学方程式;欲制得纯净干燥的SO3,若C中盛放NaOH溶液需将C装置换成f,或将e、m依次连接在B、C之间;
(3)硫酸亚铁吸收NO,Fe2++NO=Fe(NO)2+生成配合物;根据反应6NO+4NH3═5N2+6H2O计算NO的转化率;
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,据此书写化学方程式;欲制得纯净干燥的SO3,若C中盛放NaOH溶液需将C装置换成f,或将e、m依次连接在B、C之间;
(3)硫酸亚铁吸收NO,Fe2++NO=Fe(NO)2+生成配合物;根据反应6NO+4NH3═5N2+6H2O计算NO的转化率;
解答:解:(1)氨气和氧气发生催化氧化反应,氨气中-3价的氮被氧气氧化成-2价的一氧化氮中的氮,反应化学方程式为4NH3+5O2
4NO+6H2O;生成的一氧化氮易被氧气氧化,反应方程式为2NO+O2=2NO2,二氧化氮为红棕色,二氧化氮会转化为无色的四氧化二氮,反应方程式为2NO2(红棕)?N2O4(无色),该反应的正反应为放热反应,根据平衡移动的原理,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅;
故答案为:4NH3+5O2
4NO+6H2O;因为2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅;
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,+6铬变为产物中的+3价铬,二氧化硫中+4价的硫变为产物中+6价的硫,反应方程式为Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O,欲制得纯净干燥的SO3,需用浓硫酸干燥需选e,不能选f,然后用m收集,将e、m依次连接在B、C之间或将C装置换成f,
故答案为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O;将e、m依次连接在B、C之间或将C装置换成f;
(3)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为FeSO4+NO=Fe(NO)SO4,根据反应6NO+4NH3═5N2+6H2O计算,在一定条件下气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6mol 5mol
V 2016ml
V=
,则NO的转化率为
×100%=90%,
故答案为:吸收未反应的NO;
×100=90%;
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,+6铬变为产物中的+3价铬,二氧化硫中+4价的硫变为产物中+6价的硫,反应方程式为Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O,欲制得纯净干燥的SO3,需用浓硫酸干燥需选e,不能选f,然后用m收集,将e、m依次连接在B、C之间或将C装置换成f,
故答案为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O;将e、m依次连接在B、C之间或将C装置换成f;
(3)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为FeSO4+NO=Fe(NO)SO4,根据反应6NO+4NH3═5N2+6H2O计算,在一定条件下气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6mol 5mol
V 2016ml
V=
| 2016ml×6mol |
| 5mol |
| 2016×6 |
| 2688×5 |
故答案为:吸收未反应的NO;
| 2016×6 |
| 2688×5 |
点评:本题考查的知识点较多,主要考查了氨气的催化氧化、二氧化硫的还原性、一氧化氮的性质和一氧化氮和氨气的反应的计算等知识,依据相关知识结合装置图进行分析解答是答题的关键,题目较为综合,具有一定难度.

练习册系列答案
相关题目
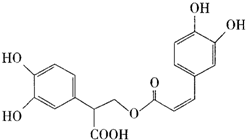 (2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )
(2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )

