题目内容
(2010?崇文区一模)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇.“绿色自由”构想技术流程如图1所示:

(1)分解池中发生分解反应的物质是
(2)在合成塔中,若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
(3)①从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300℃的温度,原因之一是考虑到催化剂的催化活性,原因之二是
②从合成塔中分离出甲醇的原理与下列哪个相符
a.过滤b.分液c.蒸馏
③“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括
(4)图2是甲醇燃料电池的结构示意图.已知电池总反应为:2CH3OH+3O2=2CO2+4H2O.通入a-端的电极是

(1)分解池中发生分解反应的物质是
KHCO3
KHCO3
.(2)在合成塔中,若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
CO2(g)+3H2(g)=H2O(g)+CH3OH(g)△H=-49.47kJ/mol
CO2(g)+3H2(g)=H2O(g)+CH3OH(g)△H=-49.47kJ/mol
.(3)①从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300℃的温度,原因之一是考虑到催化剂的催化活性,原因之二是
考虑反应快慢
考虑反应快慢
.②从合成塔中分离出甲醇的原理与下列哪个相符
c
c
(选填字母).a.过滤b.分液c.蒸馏
③“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括
高温水蒸气
高温水蒸气
.(4)图2是甲醇燃料电池的结构示意图.已知电池总反应为:2CH3OH+3O2=2CO2+4H2O.通入a-端的电极是
负极
负极
(填“正极”或“负极”),负极发生的电极反应是CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
.分析:(1)根据碳酸氢钾受热分解的化学性质解答;
(2)计算出生成1mol甲醇放出的热量,即可写出反应的热化学方程式,书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;
(3)①工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
②从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大;
③由流程图可以找出循环利用的物质;
(4)负极上燃料甲醇失电子发生氧化反应,正极上是氧化剂得电子发生还原反应.
(2)计算出生成1mol甲醇放出的热量,即可写出反应的热化学方程式,书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;
(3)①工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
②从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大;
③由流程图可以找出循环利用的物质;
(4)负极上燃料甲醇失电子发生氧化反应,正极上是氧化剂得电子发生还原反应.
解答:解:(1)高温水蒸气,碳酸氢钾受热可分解成碳酸钾、二氧化碳和水,方程式为:2KHCO3
K2CO3+H2O+CO2↑,故答案为:KHCO3;
(2)2.2kgCO2的物质的量为:n=
=
=50mol,则1 mol CO2与氢气合成甲醇放出热量为:
=49.47kJ/mol,则合成塔中发生反应的热化学方程式为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ?mol-1,
故答案为:CO2(g)+3H2(g)=H2O(g)+CH3OH(g)△H=-49.47kJ/mol;
(3)①从平衡移动原理分析,低温有利于原料气的转化,但温度越高,反应越快,所以实际生产中采用300°C的温度,是因为在用300°C时,催化剂活性最大,反应速率最快,故采用此温度,
故答案为:考虑反应快慢;
②从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大,可用蒸馏的方法分离,故答案为:c;
③从反应流程来看,分解池需要高温水蒸气,而合成塔温度在300°C,故分离出甲醇后,水蒸气可循环利用,故答案为:高温水蒸气;
(4)燃料电池中,负极上是燃料失电子发生氧化反应,正极上是氧化剂得电子发生还原反应,通过图片知,氢离子从左向右移动,说明a处通入的是甲醇,甲醇反应生成氢离子,电极反应式为:CH3OH+H2O-6e-=CO2+6H+,氢离子到达b处和氧气反应生成水,所以b处通入的物质是氧气,氧气得电子发生还原反应,
故答案为:负极;CH3OH+H2O-6e-=CO2+6H+.
| ||
(2)2.2kgCO2的物质的量为:n=
| m |
| M |
| 2200g |
| 44g/mol |
| 2473.5kJ |
| 50mol |
故答案为:CO2(g)+3H2(g)=H2O(g)+CH3OH(g)△H=-49.47kJ/mol;
(3)①从平衡移动原理分析,低温有利于原料气的转化,但温度越高,反应越快,所以实际生产中采用300°C的温度,是因为在用300°C时,催化剂活性最大,反应速率最快,故采用此温度,
故答案为:考虑反应快慢;
②从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大,可用蒸馏的方法分离,故答案为:c;
③从反应流程来看,分解池需要高温水蒸气,而合成塔温度在300°C,故分离出甲醇后,水蒸气可循环利用,故答案为:高温水蒸气;
(4)燃料电池中,负极上是燃料失电子发生氧化反应,正极上是氧化剂得电子发生还原反应,通过图片知,氢离子从左向右移动,说明a处通入的是甲醇,甲醇反应生成氢离子,电极反应式为:CH3OH+H2O-6e-=CO2+6H+,氢离子到达b处和氧气反应生成水,所以b处通入的物质是氧气,氧气得电子发生还原反应,
故答案为:负极;CH3OH+H2O-6e-=CO2+6H+.
点评:本题为综合题,考查了热化学方程式的书写,电极反应式的书写,催化剂的影响因素等知识点,掌握基础知识并熟练运用这些知识是解答的关键,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
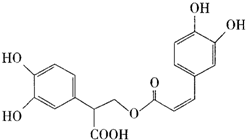 (2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )
(2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )
