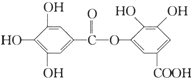
题目内容
【题目】现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有_______________,含有非极性键的离子化合物的是__________。
(2)N2、CO2的结构式分别为________________、_________________。
(3)分别写出NaOH、H2O2、Na2O2的电子式:_______________、_____________、______________。
【答案】 CO2、 H2O2 Na2O2 N≡N O=C=O ![]()
![]()
![]()
![]()
![]()
![]()
【解析】(1)本题考查化学键与物质类别,共价化合物属于是化合物,只含有共价键,CO2属于化合物,只有共价键,属于共价化合物,N2属于单质,不是共价键化合物,CaCl2属于离子化合物,只含离子键,NH4Cl属于离子化合物,含有离子键和共价键,NaOH属于离子化合物,含有离子键和共价键,H2O2属于共价化合物,含有极性共价键和非极性共价键,Na2O2属于离子化合物,含有离子键和非极性共价键,属于共价化合物的是CO2和H2O2,含有非极性键和离子键的是Na2O2;(2)N2中两个氮原子共用三个电子对,结构式为N≡N,CO2中C和O共用2个电子对,结构式为O=C=O;(3)电子式分别是![]()
![]() 、
、 ![]() 、
、 ![]()
![]() 。
。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目