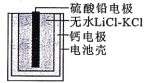
题目内容
【题目】NaCl是一种化工原料,可以制备一系列物质,如下图所示。下列说法正确的是

A. 石灰乳与Cl2的反应中,Cl2既是氧化剂又是还原剂
B. 25℃时,NaHCO3 在水中的溶解度比Na2CO3 大
C. Cl2与过量的铁反应生成FeCl2
D. 图示转化反应都是氧化还原反应
【答案】A
【解析】A、石灰乳与Cl2反应的化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,只有Cl元素化合价发生改变,Cl2既是氧化剂又是还原剂,故A正确;B、25℃,NaHCO3在水中的溶解度比Na2CO3要小,如在饱和Na2CO3溶液中通入CO2会生成NaHCO3沉淀,故B错误;C、Cl2为强氧化剂,与Fe反应时,无论铁过量、少量,均生成FeCl3,故C错误;D、NaCl→NaHCO3→Na2CO3,两步转化均没有化合价的改变,属于非氧化还原反应,故D错误。故选A。

 习题精选系列答案
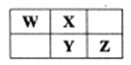
习题精选系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径由大到小的顺序为______(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____________________。
(4)②单质与③的最高价氧化物的水化物的浓溶液在加热的条件下反应的化学方程式为__________________________________________。
(5)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最价氧化物反应的化学方程式为___________________________。
(6)⑨的非金属性比⑧的非金属性______(填“强”或“弱”)。符合上述事实是依据有____(选择a-f序号填空)。
a. ⑧的单质的沸点比⑨的单质沸点高
b. ⑨的氢化物比⑧的氢化物稳定
c. ⑨的最外层电子数比⑧的多
d. ⑧的最高价氧化物的水化物的酸性比⑨的最高价氧化物的水化物的酸性弱
e. ⑨的单质能与⑧的氢化物反应生成⑧的单质
f. ⑨的氢化物的酸性比⑧的氢化物的酸性强
(7)化合物甲是元素③形成的最简单氢化物,甲的电子式是_________________。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是______________。
(8)①和③形成的18电子的化合物乙是一种应用广泛的化工原料,写出乙的化学式________。实验室中可用次氯酸钠溶液与氨反应制备乙,反应的化学方程式为__________________。