题目内容
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
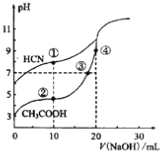
A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
【答案】B
【解析】点①溶液有电荷守恒:c(CN-)+c(OH-)=c(Na+)+c(H+),所以点①溶液的c(CN-)=c(Na+)+c(H+)-c(OH-);点②溶液有电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以点②溶液的c(CH3COO-)=c(Na+)+c(H+)-c(OH-);因为两点所处的溶液中加入的氢氧化钠溶液体积相等,所以c(Na+)一定相等,而点①溶液的pH高于点②溶液,即点①溶液的c(H+)小于点②溶液而且点①溶液的c(OH-)大于点②溶液,所以得到点①溶液的c(Na+)+c(H+)-c(OH-)一定小于点②溶液的c(Na+)+c(H+)-c(OH-),即点①溶液的c(CN-)小于点②溶液的c(CH3COO-),选项A错误。开始时为20.00mL浓度均为0.10 mol·L-1 的CH3COOH溶液和HCN溶液,所以两溶液中CH3COOH和HCN的物质的量相等,由物料守恒得到:n(CH3COO-)+ n(CH3COOH) =n(HCN)+n(CN-),加入氢氧化钠不会影响上述的物料守恒,所以等式依然成立,点①和点②所示溶液的体积相等,所以在等式:n(CH3COO-)+ n(CH3COOH) =n(HCN)+n(CN-)的两侧都除以相同的溶液体积得到:c(CH3COO-)+ c(CH3COOH) =c(HCN)+c(CN-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),选项B正确。点④所示溶液加入了20mL的氢氧化钠溶液,此时酸碱恰好中和,形成CH3COONa溶液,该溶液的离子溶度顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),选项C错误。根据电荷守恒,点②和点③所示溶液中都有: c(CH3COO-)+c(OH-)=c(Na+)+c(H+),如果题目所说两点所示溶液都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)成立,则两点溶液都应该有c(Na+)=c(CH3COOH),实际两点溶液均不存在以上结果。点②所示溶液加入了10mL氢氧化钠溶液,中和一半的醋酸,应该得到CH3COOH和CH3COONa浓度相等的混合溶液,此时溶液显酸性,可以认为CH3COOH的电离大于CH3COO-的水解,所以有c(CH3COO-)>c(Na+)>c(CH3COOH),即c(Na+)≠c(CH3COOH);点②所示溶液中已经是c(Na+)>c(CH3COOH),随着氢氧化钠的加入c(Na+)增大,c(CH3COOH)减小,点③所示溶液中两者更不可能相等,选项D错误。

【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
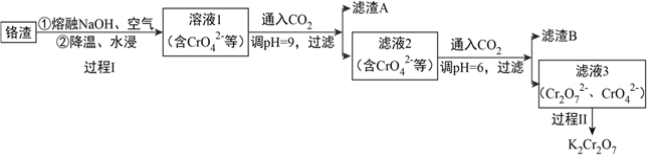
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式 .
(2)B元素在周期表中的位置;离子半径:BA(填“大于”或“小于”).
(3)C原子的电子排布图是 , 其原子核外有个未成对电子,能量最高的电子为轨道上的电子,其轨道呈形.
(4)D原子的电子排布式为 , D﹣的结构示意图是 .
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为与D的氢化物的水化物反应的化学方程式为 .
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1molL﹣1的盐酸进行滴定,完成下列问题: ①称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
②将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
③取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外) , 用酚酞作指示剂时,滴定到溶液颜色由色刚好变成色为止;
④某同学根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)= .
⑤由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
