题目内容
20.某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如表:| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1,反应在10至20分钟时间内A平均速率为0.013mol/(L.min).
(2)实验2,A的初始浓度c2=1.0 mol•L-1,推测实验2中还隐含的条件是加入催化剂.
(3)800℃时该反应的平衡常数K=0.25
(4)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、<、=),且C3=1.2mol•L-1.
分析 (1)实验1,反应在10至20分钟时间内△c(A)=(0.8-0.67)mol/L=0.13mol/L,再根据c=$\frac{△c}{△t}$计算v(A);
(2)实验1、2温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同;到达平衡时实验2的时间较短,实验2应是加入催化剂;
(3)根据实验1计算平衡时各组分物质的量浓度,代入K=$\frac{c(B)×c(D)}{{c}^{2}(A)}$计算平衡常数;
(4)实验1、3温度相同,由于反应前后气体体积不变,二者为等效平衡,平衡时实验3中A的浓度大,说明A的起始浓度大,浓度越大反应速率越快,平衡时实验1、3中A的转化率相等,进而计算实验3中A的起始浓度.
解答 解:(1)实验1,反应在10至20分钟时间内△c(A)=(0.8-0.67)mol/L=0.13mol/L,则v(A)=$\frac{0.13mol/L}{10min}$=0.013mol/(L.min),故答案为:0.013mol/(L.min);
(2)实验1、2温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol•L-1 ,到达平衡时实验2的时间较短,实验2应是加入催化剂,
故答案为:1.0;加入催化剂;
(3)实验1平衡时A的浓度为0.5mol/L,则:
2A(g)?B(g)+D(g)
起始浓度(mol/L):1 0 0
变化浓度(mol/L):0.5 0.25 0.25
平衡浓度(mol/L):0.5 0.25 0.25
800℃时该反应的K=$\frac{c(B)×c(D)}{{c}^{2}(A)}$=$\frac{0.25×0.25}{0.{5}^{2}}$=0.25m,
故答案为:0.25;
(4)实验1、3温度相同,由于反应前后气体体积不变,二者为等效平衡,平衡时实验3中A的浓度大,说明A的起始浓度大,浓度越大反应速率越快,即v3>v1,
平衡时实验1、3中A的转化率相等,实验1中A的转化率为50%,故实验3中A的起始浓度C3=$\frac{0.6mol/L}{50%}$=1.2mol/L,
故答案为:>;1.2.
点评 本题考查化学平衡计算与影响因素、反应速率计算等,侧重考查学生对实验数据的分析处理能力,(4)中注意利用等效平衡解答,也可以利用平衡常数计算.

 阅读快车系列答案
阅读快车系列答案| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 向某无色溶液中滴加BaCl2溶液,出现白色沉淀,说明溶液中存在SO42- | |
| C. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
| A. | 1.5 mol•L-1 | B. | 1 mol•L-1 | C. | 0.15 mol•L-1 | D. | 3 mol•L-1 |
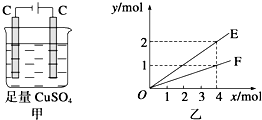
| A. | F表示反应生成Cu的物质的量 | B. | E表示反应生成O2的物质的量 | ||
| C. | E表示反应实际消耗H2O的物质的量 | D. | F表示反应生成H2SO4的物质的量 |
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
(2)达到滴定终点的标志是无色变粉红色且30s不变色.
(3)以下操作造成测定结果偏高的原因可能是ADE.
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
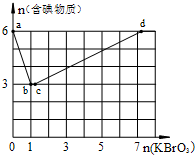 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.