题目内容
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为_____________。(溶液混合前后体积变化可忽略)
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是_____________。
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | _____________ | 2.0 | 2.0 | 3.0 | MnSO4 | t |
③若该小组同学提出的假设成立,t_____________1.5(填“大于”、“小于”或“等于”)。
【答案】 其他条件不变时,增大H2C2O4浓度(或增大反应物浓度),加快化学反应速率 1.0×10-2mol/(L·min) 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) 3.0 小于
【解析】(1)三个实验中改变的是草酸用量,其他物质不变,所以研究的是草酸浓度对反应速率的影响。
(2)褪色时间为1.5min;高锰酸钾初始浓度为3×0.05/(3+2+2+3)=0.015mol/L;所以速率为:0.015÷1.5=1.0×10-2mol/(L·min)
(3)根据实验图像,得到反应速率先加快后减慢,结合课本上的对应实验,得出硫酸锰对反应起到催化作用。进行实验时应注意其他条件不变,所以溶液总体积应该为10mL,所以草酸加3mL。如果催化反应,时间当然比1.5min小。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度gcm-3 | 水溶性 |
A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是
A.萃取B.升华C.分馏D.分液
【题目】中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
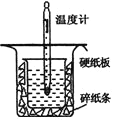
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是_____________。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”或“不相等”)
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_______( 结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
