题目内容
【题目】下列说法中正确的是( )
A.标准状况下,22.4L水中所含的分子数约为6.02×1023
B.标准状况下,aL的氧气和氮气的混合物含有的分子数约为 ![]() ×6.02×1023
×6.02×1023
C.常温常压下,48g O3气体含有的氧原子数为6.02×1023
D.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
【答案】B
【解析】解:A、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、标况下aL混合气体的物质的量为n= ![]() mol,故分子个数N=nNA=
mol,故分子个数N=nNA= ![]() 个,故B正确;
个,故B正确;
C、臭氧由氧原子构成,故48g臭氧中含有的氧原子的物质的量n= ![]() =3mol,个数为3NA个,故C错误;
=3mol,个数为3NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁形成的胶粒的个数小于NA个,故D错误.
故选B.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为_____________。(溶液混合前后体积变化可忽略)
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
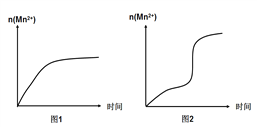
①该小组同学提出的假设是_____________。
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | _____________ | 2.0 | 2.0 | 3.0 | MnSO4 | t |
③若该小组同学提出的假设成立,t_____________1.5(填“大于”、“小于”或“等于”)。
【题目】工业上利用回收的合金废料(主要含Fe、Cu、Co、Si、Li)进行深度加工的工艺流程如图:

已知:①Fe、Co、Ni为同族元素,化学性质相似
②Li2CO3微溶于水,其饱和溶液的物质的量浓度与温度关系如表所示
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
回答下列问题:
(1)流程中残渣M的主要成分为____。
(2)“浸出液”中加入H2O2后,为检测Fe2+是否完全被氧化,最佳试剂为____;加入氨水发生反应的离子方程式为_________________。
(3)为减少Li2CO3的溶解损失,“操作3”应为蒸发浓缩、______、洗涤、干燥。
(4)将CoC2O4·2H2O样品于空气中加热,样品质量随温度变化的曲线如图所示,曲线中300℃及以上所得固体为钴的氧化物。实验室中应置于______(填仪器名称)焙烧样品。通过计算确定C点剩余固体的化学成分为_______;试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_______________。
