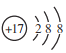题目内容
【题目】将一定物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1L溶液,取出50mL溶液,然后滴加一定物质的量浓度的盐酸与它反应,得到的图象如下,下列说法正确的是
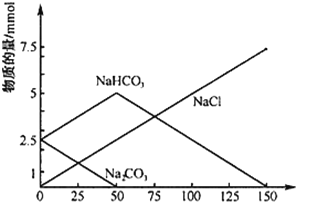
A. 标注 NaCl的直线代表产生的CO2的物质的量
B. 原混合物中Na2CO3与NaHCO3的物质的量之比为1:2
C. 盐酸的浓度是0.05 mol/L
D. 盐酸加到150mL时,放出CO2气体2.24L(标准状况下)
【答案】C
【解析】
A、0~50mL时发生的反应为:Na2CO3+HCl=NaCl+NaHCO3,没有CO2产生,故A错误;
B、从图中(0,2.5)看出,原混合物中Na2CO3与NaHCO3的物质的量之比为1:1,故B错误;
C、由图可知50mL溶液中碳酸钠完全转化为碳酸氢钠和氯化钠时,消耗盐酸的体积为50mL,由Na2CO3+HCl=NaCl+NaHCO3可知:n(Na2CO3)=n(HCl)=0.0025mol,c(HCl)=0.0025mol÷0.05L=0.05mol·L-1,故C正确;
D、50~150mL时,发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,可知n(CO2)=n(HCl)=100×10-3L×0.05mol·L-1×22.4L·mol-1=0.112L=112mL,故D错误。
故选C。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目