题目内容
17.鉴定硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H2O]所得晶体中含有Fe2+、NH4+、SO42-离子的实验方法不正确的是( )| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
分析 Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,通入氯气或加入氯水变为血红色或加入NaOH溶液,先产生白色沉淀,然后变成灰绿色最终变成红褐色;
NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝;
SO42-的检验方法:取少量样品于试管,先加入盐酸后无现象,再加入BaCl2溶液,产生白色沉淀,据此进行判断.
解答 解:A.Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,通入氯气变为血红色,而不能先通入氯气,否则无法判断原溶液中是否含有亚铁离子,故A错误;
B.Fe2+的检验方法:取少量样品于试管中,加入NaOH溶液,先产生白色沉淀,然后变成灰绿色最终变成红褐色,故B正确;
C.NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝,故C正确;
D.SO42-的检验方法:取少量样品于试管,先加入盐酸后无现象,排除干扰离子,再加入BaCl2溶液,产生白色沉淀,故D正确;
故选A.
点评 本题考查了常见离子的检验,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,明确检验离子的存在时,必须排入干扰离子,确保检验方案的严密性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.信息、材料、能源被称为新科技革命的“三大支柱”.下列有关资讯错误的是( )
| A. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| B. | 中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源 | |
| C. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| D. | 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体 |
5.有一无色溶液,可能含有K+、Ag+、Al3+、Mg2+、NH4+、Cl-、SO32-、SO42-、I-、Br-、HCO3-、AlO2-、MnO4-中的几种.为确定其成分,做如下实验:
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀;再加热,未见有气体放出;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;分液后,向水层加入BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀;再加热,未见有气体放出;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;分液后,向水层加入BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
2.下列各组物质中,化学键类型完全相同的是( )
| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和O3 | D. | CCl4和KCl |
9.合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1mol、1mol、2mol、2mol,此时该反应由正反应方向开始建立平衡.
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
6.通过核裂变产生核能可以用于发电,${\;}_{92}^{235}$U是一种常用的核燃料,下列说法错误的是( )
| A. | U元素的近似相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中中子数比质子数多51 | |
| C. | ${\;}_{92}^{235}$U与${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U属于同一种元素 |
 以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题: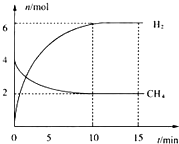 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中. ;
; .
. .
.