题目内容
7. 以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:(1)B极上的电极反应式为CH4+4O2--8e-=CO2+2H2O
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
分析 (1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水;
(2)开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
解答 解:(1)由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极方程式为CH4+4O2--8e-=CO2+2H2O,
故答案为:CH4+4O2--8e-=CO2+2H2O;
(2)硫酸铜的物质的量=0.1L×2mol/L=0.2mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,
根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,
故答案为:1.12 L.
点评 本题综合考查电化学知识,为高频考点,侧重于学生的分析、计算能力的考查,解答本题要注意把握原电池的工作原理,把握电极方程式的书写,题目难度中等.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| A. | H2O | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
| A. | Cl-、ClO-、Cl2三种微粒只具有氧化性,没有还原性 | |
| B. | Cl2具有强氧化性,可以把水中的氧置换出来 | |
| C. | 因为SO2具有还原性,所以与氯水可以反应生成H2SO4和HCl | |
| D. | Cl2转变为HClO时一定需要加入氧化剂才能实现 |
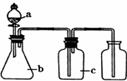 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| B. | 纤维素在人体内可以水解为葡萄糖,故可作人类的营养物质 | |
| C. | 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ | |
| D. | “地沟油”禁止食用,但可以用来做肥皂 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
 、
、 .
.