题目内容
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为
【答案】
(1)![]() ;放热
;放热
(2)BC
(3)否;向逆反应方向
(4)83.3%(或83%,或5/6)
【解析】解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,但不包含固体和纯液体,所以该反应化学平衡常数K= ![]() ;升高温度平衡向吸热方向移动,根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,所以答案是:
;升高温度平衡向吸热方向移动,根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,所以答案是: ![]() ;放热;(2)A.该反应前后气体物质的量不变,所以反应是否达到平衡状态容器中压强都不变,所以不能判断平衡状态,故错误;
;放热;(2)A.该反应前后气体物质的量不变,所以反应是否达到平衡状态容器中压强都不变,所以不能判断平衡状态,故错误;
B.混合气体中c(CO)不变时,正逆反应速率相等,反应达到平衡状态,故正确;
C.v逆(H2)=v正(H2O)=v正(H2),正逆反应速率相等,反应达到平衡状态,故正确;
D.c(CO2)=c(CO)时该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始量及转化率有关,所以不能判断平衡状态,故错误;
故选BC;(3)因为该反应中各气体计量数都是1,所以化学平衡常数也等于生成物物质的量之积与反应物物质的量之积的比,830℃时,化学平衡常数K=1.0,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,该体系中浓度商= ![]() =1.07>1,该反应没有达到平衡状态,要使反应达到平衡状态,应该向逆反应方向移动,
=1.07>1,该反应没有达到平衡状态,要使反应达到平衡状态,应该向逆反应方向移动,
所以答案是:否;向逆反应方向;(4)该温度下化学平衡常数K为1.0,设参加反应的n(CO)=xmol,根据方程式知,参加反应的n(H2O)=n(H2)=n(CO2)=n(CO)=xmol,K= ![]() ,x=
,x= ![]()
转化率= ![]() ×100%=
×100%= ![]() =.83.3%(或83%,或5/6),
=.83.3%(或83%,或5/6),
所以答案是:83.3%(或83%,或5/6).
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
项 | ① | ② | ③ | 实验结论 |
|
A | 稀盐酸 | Na2SO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si | |
B | 稀硫酸 | Na2S | 滴加少量AgNO3的KI溶液 | Ksp(AgI)>Ksp(Ag2S) | |
C | 浓盐酸 | KMnO4 | AgNO3和稀硝酸混合溶液 | Cl2溶于水有Cl﹣生成 | |
D | 浓硫酸 | 蔗糖 | Ba(OH)2溶液 | SO2能与碱溶液反应 |
A.A
B.B
C.C
D.D
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
(i)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体g.
(ii)从图中选择称量NaOH固体所需要的仪器是(填字母):
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示. 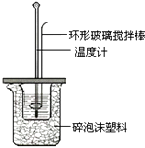
(i)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(ii)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4/p> | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.