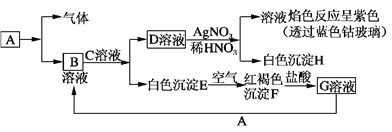
题目内容
【题目】已知某反应是放热反应,下列说法正确的是
A. 该反应中反应物的总能量大于生成物的总能量
B. 该反应中反应物的总能量小于生成物的总能量
C. 该反应发生时,一定不需要加热
D. 如果该反应开始时需加热,则一直要加热反应才能继续进行
【答案】A
【解析】
A、当反应物的总能量大于生成物的总能量时,反应是放热反应,故A正确;
B、当反应物的总能量小于生成物的总能量时,反应是吸热反应,故B错误;
C、有的放热反应需要在加热的条件下才能发生,如铝热反应是放热反应,需要在加热的条件下进行,故C错误;
D、放热反应加热到一定温度开始引发,然后停止加热,反应放出的热量已满足反应所需温度,反应能继续进行,故D错误;
故选A。

练习册系列答案
相关题目
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为