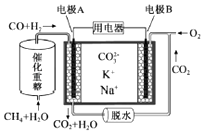
��Ŀ����
����Ŀ����CaSO4����O2��ȼ��CO��Ӧ��һ�ָ�Ч����������ȼ�ռ�������Ӧ���£�
�� ![]() CaSO4��s��+CO��g��
CaSO4��s��+CO��g�� ![]() CaS��s��+CO2��g����H1=��47.3��kJmol��1
CaS��s��+CO2��g����H1=��47.3��kJmol��1
��CaSO4��s��+CO��g��CaO��s��+CO2��g��+SO2��g����H2=+210.5kJmol��1
��CO��g�� ![]() C��s��+
C��s��+ ![]() CO2��g����H3=��86.2kJmol��1 ��
CO2��g����H3=��86.2kJmol��1 ��
����˵��������ǣ� ��
A.��Ӧ�ٴﵽƽ��ʱ������ѹǿƽ�ⲻ�ƶ�
B.��Ӧ�ڵ�ƽ�ⳣ������ʽΪK= ![]()
C.��Ӧ�ٺ͢�������Ӧ����Ӧ���Ǹ���Ӧ
D.2CaSO4��s��+7CO��g��?CaS��s��+CaO��s��+6CO2��g��+C��s��+SO2��g���Ƿ��ȷ�Ӧ
���𰸡�C
���������⣺A����Ӧ��ǰ������������䣬�ı�ѹǿ��Ӱ�컯ѧƽ�⣬ƽ�ⲻ�ƶ�����A��ȷ��B��ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻���ע�����ʹ�Һ�岻д��ƽ�ⳣ������ʽ����Ӧ�ڵ�ƽ�ⳣ������ʽΪK= ![]() ����B��ȷ��
����B��ȷ��
C����CaSO4����O2��ȼ��CO��Ӧ��һ�ָ�Ч����������ȼ�ռ�������Ӧ��������Ӧ����Ӧ�ڢ��Ǹ���Ӧ����C����
D�������Ȼ�ѧ����ʽ��˹���ɼ���������� ![]() CaSO4��s��+CO��g��
CaSO4��s��+CO��g�� ![]() CaS��s��+CO2��g����H1=��47.3kJmol��1
CaS��s��+CO2��g����H1=��47.3kJmol��1
��CaSO4��s��+CO��g��CaO��s��+CO2��g��+SO2��g����H2=+210.5kJmol��1
��CO��g�� ![]() C��s��+
C��s��+ ![]() CO2��g����H3=��86.2kJmol��1 ��
CO2��g����H3=��86.2kJmol��1 ��
�١�4+��+�ۡ�2�õ���2CaSO4��s��+7CO��g��CaS��s��+CaO��s��+6CO2��g��+C��s��+SO2��g����H=��151.1KJ/mol����Ӧ�Ƿ��ȷ�Ӧ����D��ȷ��
��ѡC��
�����㾫����ͨ��������û�ѧƽ��״̬���ʼ����������ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�������Խ����⣮

����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��
CO��g��+H2O��g�� ![]() CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= �� �÷�ӦΪ��Ӧ��ѡ����ȡ��������ȡ�����
��2�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬����������
A.������ѹǿ����
B.���������c��CO������
C.v����H2��=v����H2O��
D.c��CO2��=c��CO��
��3��830��ʱ�������еķ�Ӧ�Ѵﵽƽ�⣮�������������������£��ڴ��¶��£����������к���1molCO2��1.2molH2��0.75molCO��1.5molH2O����״̬���ǻ����ƽ��״̬�������ǣ���Ӧ���ĸ�������У� �� ��ѡ�������Ӧ���������淴Ӧ������
��4����830��ʱ���������г���lmolCO��5molH2O����Ӧ�ﵽƽ���CO��ת����Ϊ