题目内容
13.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入70mL 4.0mol/L盐酸中,充分反应后产生448mL H2(标准状况),残留固体0.64g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.20mol/L.则原混合物中单质铁的质量是( )| A. | 2.80g | B. | 3.25g | C. | 3.36g | D. | 4.48g |
分析 根据溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,阳离子为H+和Fe2+.根据原子守恒和得失电子总数相等计算.
解答 解:既然还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu.
而Cu可以残留说明溶液中没有Fe3+,阳离子为H+和Fe2+,反应有:CuO+2H+═Cu2++H2O、Fe2O3+6H+═2Fe3++3H2O,、Fe+2Fe3+═3Fe2+、Fe+Cu2+═Fe2++Cu、Fe+2H+═Fe2++H2↑,
根据原子守恒和得失电子总数相等计算,设原有Fe为xmol,Fe2O3为ymol,CuO为zmol,
生成Cu为:$\frac{0.64g}{64g/mol}$=0.01mol,
生成H2为:$\frac{0.448L}{22.4L/mol}$=0.02mol,
根据得失电子总数相等知:2x=2y+2×0.01+2×0.02;
又根据Cl-知:2(x+2y)+0.2×0.200=0.07×4.0,
将上述两式联立解出:x=0.06,y=0.03,
原混合物中单质铁的质量为:56g/mol×0.06mol=3.36g,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,本题注意从溶液存在的离子判断物质反应的程度,利用守恒的方法计算,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.某澄清、透明的浅黄色溶液中,可能含有下列八种离子:Na+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-,在设计检验方案前的初步分析中,可确定该溶液中能大量存在的离子最多有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
1.下列物质中,属于烷烃的是( )
| A. | 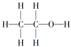 | B. | 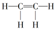 | C. |  | D. | 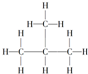 |
8.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第3周期第ⅡA族 |
18.下列分子中,含有两个π键的是( )
①H-C≡N ②H2O ③N2 ④H2O2⑤C2H4 ⑥C2H2.
①H-C≡N ②H2O ③N2 ④H2O2⑤C2H4 ⑥C2H2.
| A. | ①③⑥ | B. | ③④⑤⑥ | C. | ①②③⑥ | D. | ③⑤⑥ |
5.据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是( )
| A. | 在此反应中,每生成1molO2(PtF6),则转移1mol电子 | |
| B. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| C. | O2(PtF6)中氧元素的化合价是+1价 | |
| D. | O2(PtF6)中仅存在离子键不存在共价键 |
3.现代化学测定有机化合物结构的分析方法比较多,经常采用的是1H核磁共振(1H-NMR)、红外光谱(IR)等方法.在1H-NMR分析中,有机物分子中的氢原子核所处的化学环境(即附近的基团)不同,表现出的核磁性不同,代表核磁性特征的峰在核磁共振谱图中横坐标的位置也就不同.下图1和图2是A、B两种物质的1H核磁共振氢谱.已知A、B两种物质都含有6个氢原子.请根据图1和图2两种物质的核磁共振氢谱图选择出不可能属于图1和图2的两种物质是( )
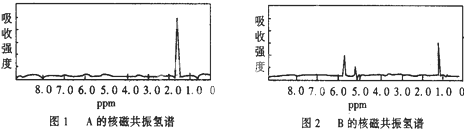

| A. | A是C3H6;B是C2H6 | B. | A是C2H6;B是C3H6 | ||
| C. | A是C2H6O;B是C3H6 | D. | A是C3H6;B是C2H6O |
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.