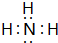题目内容
16.下列对一些实验事实和理论解释正确的是( )| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl在水分子的作用下能电离出阴阳离子而使盐酸溶液导电,但HCl是共价化合物;
B.元素的非金属性越强,其氢化物的稳定性越强,与氢化物水溶液酸性强弱无关;
C.熔融状态下能导电的化合物中含有阴阳离子;
D.元素的非金属性越强,其氢化物的稳定性越强,与氢化物的熔沸点高低无关.
解答 解:A.HCl在水分子的作用下能电离出阴阳离子而使盐酸溶液导电,但HCl分子中只存在共价键,所以是共价化合物,结论错误,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,与氢化物水溶液酸性强弱无关,所以不能根据HBr溶液的酸性大于HCl来判断Cl、Br元素非金属性强弱,故B错误;
C.熔融状态下能导电的化合物中含有阴阳离子,为离子晶体,所以K3C60在熔融状态下能够导电,则说明K3C60中含有离子键,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,与氢化物的熔沸点高低无关,氢化物的熔沸点与氢键、相对分子质量大小有关,故D错误;
故选C.
点评 本题考查非金属性强弱判断、化学键,侧重考查学生分析判断能力,根据物质的构成微粒及微粒之间作用力判断化学键,注意氢化物的稳定性与化学键有关,氢化物的熔沸点与分子间作用力和氢键有关,为易错点.

练习册系列答案
相关题目
7.对照元素周期表,下列叙述中不正确的是( )
| A. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀合金材料的元素 | |
| B. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
4.某澄清、透明的浅黄色溶液中,可能含有下列八种离子:Na+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-,在设计检验方案前的初步分析中,可确定该溶液中能大量存在的离子最多有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
1.下列物质中,属于烷烃的是( )
| A. | 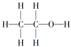 | B. | 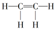 | C. |  | D. | 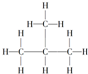 |
8.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第3周期第ⅡA族 |
5.据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是( )
| A. | 在此反应中,每生成1molO2(PtF6),则转移1mol电子 | |
| B. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| C. | O2(PtF6)中氧元素的化合价是+1价 | |
| D. | O2(PtF6)中仅存在离子键不存在共价键 |
6.下列叙述中正确的是( )
| A. | 混合物中元素一定呈化合态 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 某纯净的物质不是化合物就是单质 | |
| D. | 由同种分子组成的物质一定是纯净物 |