题目内容
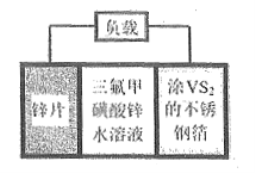
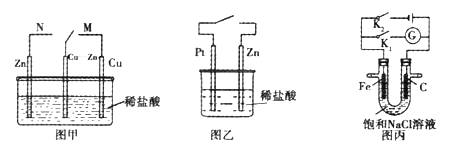
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )

A.A是Cu,B是Zn,C为硫酸铜
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
【答案】AD
【解析】
原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析。
该原电池中,A极逐渐变粗,B极逐渐变细,所以B作负极,A作正极,B的活泼性大于A的活泼性,所以排除C选项;A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,故B不选;A、D选项分别析出金属Cu和Ag,所以均符合题意。
答案选AD。

【题目】(1)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
①已知反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变
B.混合气体颜色保持不变
C.混合气体的平均相对分子质量不再变化
D.每消耗1molSO3的同时生成1 molNO2
②CO2可转化成有机物 CH3OH实现碳循环。在1L的密闭容器中,充入lmolCO2和 3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______
CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______

③工业上,CH3OH 也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中投入0.1molCO和 0.2molH2,达到平衡时,CO转化率为 50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为_________。
(3)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30g,容器内的压强(p)随时间(t)的变化如图1所示。(M(尿素)=60g/mol)
①T1℃时,该反应的平衡常数K的值为______。


②图2中能正确反映平衡常数K随温度变化关系的曲线为____(填曲线标记字母)