题目内容
【题目】用如图所示的装置及NaOH溶液、铁屑、稀H2SO4等试剂可以制得白色的Fe(OH)2沉淀。

(1)在试管Ⅰ里加入的试剂是____________________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,正确的操作顺序是______ (填下列序号)
①打开止水夹 ②检验试管Ⅱ出口处排出的H2的纯度 ③夹紧止水夹 ④在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是:_________________________________________________
【答案】 稀 H2SO4 铁屑 NaOH溶液 ④①②③ 试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
【解析】根据如图所示的装置及所提供的NaOH溶液、铁屑、稀H2SO4等试剂制得白色的Fe(OH)2沉淀,可以推断该实验的原理是:先在左边的试管中加入铁屑和稀硫酸反应制备硫酸亚铁溶液和氢气,打开止水夹,生成的氢气将盛有氢氧化钠溶液的右边的试管中的空气排出,检验右管排出的气体为纯净的氢气后,关闭止水夹,左管生成的氢气将适量硫酸亚铁溶液排入右管与氢氧化钠溶液反应生成氢氧化亚铁,再关闭止水夹,生成的氢氧化亚铁在氢气的保护下可以防止被氧气氧化,在较长的时间内能观察到白色。
(1)在试管Ⅰ里加入的试剂是稀 H2SO4 、铁屑。
(2)在试管Ⅱ里加入的试剂是NaOH溶液。
(3)为了制得白色Fe(OH)2沉淀,正确的操作顺序是:在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子;打开止水夹;检验试管Ⅱ出口处排出的H2的纯度;。所以填④①②③。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是:试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
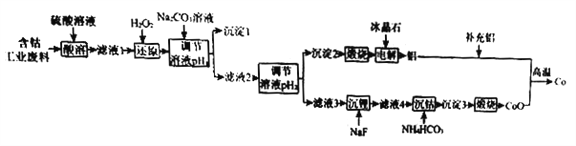
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________
