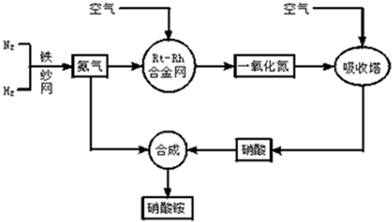
题目内容
一定条件下,体积固定的密闭容器进行可逆反应:Fe(s)+CO2(g)═FeO(s)+CO(g),在温度为938K时,平衡常数K=1.47,在1173K=2.15.下列叙述正确的是( )
分析:A.根据温度对平衡常数的影响分析温度对平衡移动的影响,据此解答;
B.增大容器的体积,压强降低,由于反应前后气体的化学计量数变,平衡不移动;
C.根据温度对平衡常数的影响分析反应是吸热还是放热,据此解答;
D.在通入CO2,可以等效为增大压强,根据压强对平衡移动的影响分析CO2的转化率.
B.增大容器的体积,压强降低,由于反应前后气体的化学计量数变,平衡不移动;
C.根据温度对平衡常数的影响分析反应是吸热还是放热,据此解答;
D.在通入CO2,可以等效为增大压强,根据压强对平衡移动的影响分析CO2的转化率.
解答:解:A.由题目信息可知,温度越高平衡常数越大,说明升高温度平衡向正反应方向移动,故CO2的平衡浓度增大,故A正确;
B.增大容器的体积,压强降低,由于反应前后气体的化学计量数变,平衡不移动,故增大容器的体积,混和气体的平均相对分子质量不变,故B错误;
C.由题目信息可知,温度越高平衡常数越大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,即△H>0,故C错误;
D.在通入CO2,可以等效为增大压强,由于反应前后气体的化学计量数变,平衡不移动,则CO2的转化率不变,故D正确,
故选AD.
B.增大容器的体积,压强降低,由于反应前后气体的化学计量数变,平衡不移动,故增大容器的体积,混和气体的平均相对分子质量不变,故B错误;
C.由题目信息可知,温度越高平衡常数越大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,即△H>0,故C错误;
D.在通入CO2,可以等效为增大压强,由于反应前后气体的化学计量数变,平衡不移动,则CO2的转化率不变,故D正确,
故选AD.
点评:本题考查温度对平衡常数及化学平衡移动的影响,D选项为易错点,注意利用等效思想解答,可以利用平衡常数计算判断,但比较麻烦,难度中等.

练习册系列答案
相关题目