题目内容
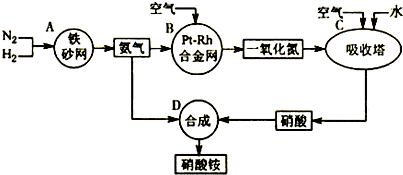
工业生产硝酸铵的流程图如下:

请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用
(2)已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量
.
②为有效提高氢气的转化率,宜采取的措施有
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3)一定温度下在体积固定的密闭容器中,将1mol N2和3mol H2混合,当该反应达到平衡时,测得平衡混合气的压强是反应前的0.85倍,此时N2的转化率为

请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用
可做氮肥等
可做氮肥等
(任写一条)(2)已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量
<
<
(填“<”“>”“=”)92.4kJ,该反应的化学平衡常数表达式K=| c2(NH3) |
| c3(H2)c(N2) |
| c2(NH3) |
| c3(H2)c(N2) |
②为有效提高氢气的转化率,宜采取的措施有
CEF
CEF
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3)一定温度下在体积固定的密闭容器中,将1mol N2和3mol H2混合,当该反应达到平衡时,测得平衡混合气的压强是反应前的0.85倍,此时N2的转化率为
30%
30%
.分析:(1)根据铵盐的用途分析;
(2)①根据可逆反应的特点不可能完全进行到底分析;依据化学平衡常数概念书写表达式;
②根据化学平衡移动分析;因增大反应物的浓度,减少生成物的浓度,增大压强,降低温度工业合成氨反应向正反应方向移动,氢气的转化率提高,但在实际生产中不能用低温,因为温度低化学反应速率慢;
(3)根据化学平衡三段式列式求出各自的物质的量,最终求出转化率;
(2)①根据可逆反应的特点不可能完全进行到底分析;依据化学平衡常数概念书写表达式;
②根据化学平衡移动分析;因增大反应物的浓度,减少生成物的浓度,增大压强,降低温度工业合成氨反应向正反应方向移动,氢气的转化率提高,但在实际生产中不能用低温,因为温度低化学反应速率慢;
(3)根据化学平衡三段式列式求出各自的物质的量,最终求出转化率;
解答:解:(1)因铵盐的主要用途是用作氮肥,故答案为:可做氮肥等;
(2)①因为可逆反应不可能完全进行到底,放出的热量比完全反应少,在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为500℃,所以放出的热量小于92.4kJ; N2(g)+3H2(g)?2NH3(g);该反应的平衡常数K=
;
故答案为:<;
②A.反应是放热反应,降低温度平衡正向进行,氢气的转化率提高,但在实际生产中不能用低温,因为温度低化学反应速率慢,故A不符合;
B.最适合催化剂活性的适当高温,温度越高氢气转化率减小,故B不符合;
C.反应是气体体积减小的反应,增大压强,平衡正向进行,氢气转化率增大,故C符合;
D.降低压强,平衡逆向进行,故D不符合;
E.循环利用和不断补充氮气,提高氢气转化率,故E符合;
F.及时移出氨,平衡正向进行,氢气转化率增大,故F符合;
故答案为:CEF;
(3)依据化学平衡的三段式列式计算得到:设氮气转化物质的量为x
N2 +3H2=2NH3
起始量(mol) 1 3 0
转化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
平衡混合气的压强是反应前的0.85倍,物质的量是反应前的0.85倍
(1-x)+(3-3x )+2x=0.85×4
得到x=0.3mol;
氢气的转化率=
×100%=30%
故答案为:30%;
(2)①因为可逆反应不可能完全进行到底,放出的热量比完全反应少,在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为500℃,所以放出的热量小于92.4kJ; N2(g)+3H2(g)?2NH3(g);该反应的平衡常数K=
| c2(NH3) |
| c3(H2)c(N2) |
故答案为:<;
| c2(NH3) |
| c3(H2)c(N2) |
②A.反应是放热反应,降低温度平衡正向进行,氢气的转化率提高,但在实际生产中不能用低温,因为温度低化学反应速率慢,故A不符合;
B.最适合催化剂活性的适当高温,温度越高氢气转化率减小,故B不符合;
C.反应是气体体积减小的反应,增大压强,平衡正向进行,氢气转化率增大,故C符合;
D.降低压强,平衡逆向进行,故D不符合;
E.循环利用和不断补充氮气,提高氢气转化率,故E符合;
F.及时移出氨,平衡正向进行,氢气转化率增大,故F符合;
故答案为:CEF;
(3)依据化学平衡的三段式列式计算得到:设氮气转化物质的量为x
N2 +3H2=2NH3
起始量(mol) 1 3 0
转化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
平衡混合气的压强是反应前的0.85倍,物质的量是反应前的0.85倍
(1-x)+(3-3x )+2x=0.85×4
得到x=0.3mol;
氢气的转化率=
| 3×0.3 |
| 3 |
故答案为:30%;
点评:本题结合工业生产硝酸铵的流程图考查了可逆反应、化学平衡常数、化学平衡三段式计算等,试题的综合性较强,题目难度中等.

练习册系列答案
相关题目