题目内容
【题目】【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
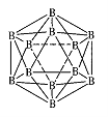
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
【答案】(1)1s2 2s22p63s23p63d104s24p1 或〔Ar〕3d104s24p1 (2)①分子晶体
②![]() ③ 平面三角形;sp3 (3)3 (4)面心立方晶胞 143
③ 平面三角形;sp3 (3)3 (4)面心立方晶胞 143
【解析】
试题分析:(1)镓是31号元素,其原子核外有31个电子,根据构造原理知其核外电子排布式为1s2 2s22p63s23p63d104s24p1 或〔Ar〕3d104s24p1 ;
(2)①分子晶体的熔沸点较低,氯化铝的熔沸点较低,所以为分子晶体;
②铝原子和氯原子之间形成共价键,还形成一个配位键,其结构为![]() ;
;
③氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3;
(3)两个10B相邻、相间、相对,所以共有3种类型结构;
(4)每个晶胞中含有铝原子个数=![]() =
=![]() =4.00,该晶胞的每个顶点上和每个面上都含有一个Al原子,为面心立方晶胞;面心立方晶胞中,每个面的对角线上三个原子紧挨着,所以对角线长度=
=4.00,该晶胞的每个顶点上和每个面上都含有一个Al原子,为面心立方晶胞;面心立方晶胞中,每个面的对角线上三个原子紧挨着,所以对角线长度=![]() ,对角线为四个Al原子半径之和,所以每个铝原子半径=
,对角线为四个Al原子半径之和,所以每个铝原子半径=![]() =143pm。
=143pm。

 阅读快车系列答案
阅读快车系列答案